SSR分型四大天王,哪个才是适合多倍体的那个它?
动植物有许多多倍体物种,同源多倍体物种(AAAA),异源多倍体物种(AAAAB
1 B
1 B
1 B
1),目前多倍体物种所用的标记仍然在SSR层面,对于多倍体物种一个特定位点有多种不同的等位基因,因此要准确区别不同的等位基因和准确确定不同等位基因的比例在分型时相对于二倍体就更加困难,动植物SSR分型目前用到的主要技术有琼脂糖凝胶电泳、聚丙烯凝胶电泳、荧光毛细管电泳,还有天昊生物基于二代测序的SSRseq
TM技术,堪称SSR分型界的这“四大天王”,今天小编就为大家介绍一下,看看哪个才是适合多倍体物种的那个它。
Number1
琼脂糖凝胶电泳
涉及技术: PCR+琼脂糖凝胶电泳;
原理:使用琼脂糖凝胶作为固体介质,借助琼脂糖凝胶的分子筛作用,混悬于溶液中的样品电荷颗粒在电场影响下向着与自身相反电荷的电极移动,核酸片段因其分子量或者分子形状的不同,电泳移动速度有差异而得到分离。
优点:
操作简便,便宜
局限性:
当DNA量少时条带显示弱或不易读出
分辨率不高,扩增产物的片段相差小于20 bp时,检测结果不可靠
条带不齐、背景模糊、泳道拖尾现象导致读带、记录有难度
常有杂带、二聚体,相邻条带不易分辨,容易出现误差,因此不适合多倍体分型
多倍体分型时条带多,需要人工判读
通量低,不适合大规模分子标记分析
Number2
聚丙烯凝胶电泳
涉及技术: PCR+聚丙烯凝胶电泳;
原理:聚丙烯酰胺凝胶是由丙烯酰胺(Acr)和交联剂N,N’一亚甲双丙烯酰胺(Bis)在催化剂过硫酸铵(AP)和加速剂四甲基乙二胺 (TEMED)的作用下聚合而成,它通过改变凝胶总质量浓度或单体与交联剂的比例控制孔洞大小,能分离、定性及定量分析蛋白质、多肽、核酸等高分子化合物。
优点:
分辨率优于琼脂糖凝胶:8%-10%的聚丙烯酰胺小板胶可分离10-20bp差异以上的PCR产物,大板胶可分离5-6bp差异的PCR产物。
位点较少时较荧光毛细管电泳便宜
局限性:
操作步骤繁琐复杂
制备技术难度较大,例如易出现漏胶、气泡、梳齿不齐等现象
所需时间长,从做胶到看带需要长达9小时以上
条带不齐、背景模糊、泳道拖尾现象导致读带、记录有难度
常有杂带、二聚体,相邻条带不易分辨,容易出现误差,因此不适合多倍体分型
人工判读基因型,耗时,容易发生错误
通量低,不适合大规模分子标记分析
Number3
荧光标记毛细管电泳
涉及技术: 多重PCR+荧光标记毛细管电泳;
原理:可以通过直接在SSR标记两侧设计一对引物,并荧光标记一条引物,再进行毛细管电泳,可以方便快速的区分不同的基因型,相关软件可依据待测材料目标峰的位置,与同一毛细管泳道的内标比较,读出目标DNA片段的准确大小。
优点:
分辨率高于传统电泳
能放少数多重PCR
局限性:
价格贵
只能看长度差异,无法精确检测SSR位点重复数
无法得到SSR位点不同等位基因间的相互比例
多重PCR体系时不同SSR标记扩增产物长度需要梯度变化
不能避免插入缺失引起的基因型误判
多倍体分型时易将滑移峰误判为等位基因
多倍体分型时容易多峰,需要人工判读
Number4
天昊SSRseqTM技术
涉及技术:多重PCR+二代测序;
原理:该技术一个扩增反应体系可以完成16-20个SSR标记的PCR反应,然后对目的片段实进行二代测序。
优点:
精确检测SSR位点重复数
传统电泳和毛细管电泳都是根据片段长度差异判断SSR多态性,受分辨率影响,如果不同等位基因长度极其相近,则条带容易重叠在一起,导致无法准确判读等位基因和基因型(对于多倍体SSR分型尤其严重),并且不能看到具体序列,而高深度的SSRseq技术(1000-5000X)可以直接检测到同一SSR位点不同等位基因的序列信息,不但能达到单碱基分辨率,并且能够准确给出每个等位基因SSR重复单元的具体重复次数。

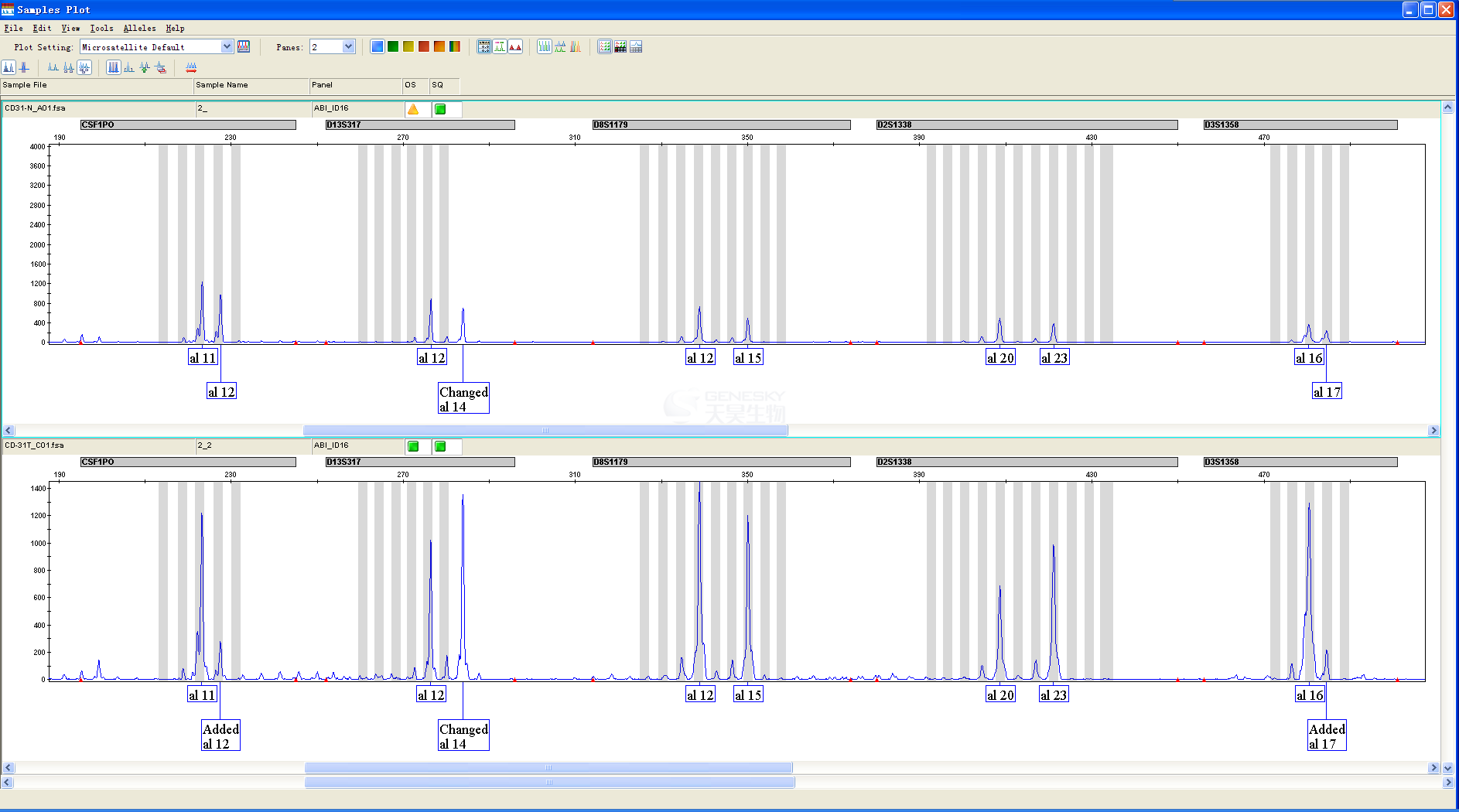
图1 多倍体物种SSRseq技术分型结果示意图,红色为SSR重复单元
避免插入缺失引起的基因型误判
传统电泳和荧光毛细管电泳SSR分型通过片段长度差异进行不同等位基因分型,插入缺失会引起条带和峰大小变化,从而导致等位基因误判,而SSRseq技术基于测序序列直接计算序列中的重复单元重复数来进行分型,可以避免插入缺失引起的序列长度变化误判。
图2 SSRseq技术分型结果示意图,红色为SSR重复单元,发现等位基因2序列中插入了TGACGA,导致比等位基因1长6bp,如果通过传统技术就会认为这个SSR分子标记是差2个GAC重复单元的2种分型,而SSRseq技术分析则认为2条序列GAC的重复单元数是一样的。
不同SSR标记扩增产物长度不需要梯度变化
毛细管电泳SSR分型通过片段长度差异进行分型,故同一个多重PCR体系内不同SSR标记扩增产物长度间需要有梯度变化(如下图),而SSRseq技术基于查看测序序列对不同SSR标记的等位基因进行分型,所以同一个多重PCR体系内不同SSR标记扩增产物长度不需要有梯度变化。
图3 毛细管电泳SSR分型时同一个多重PCR体系内不同SSR标记扩增产物长度间需要有梯度变化
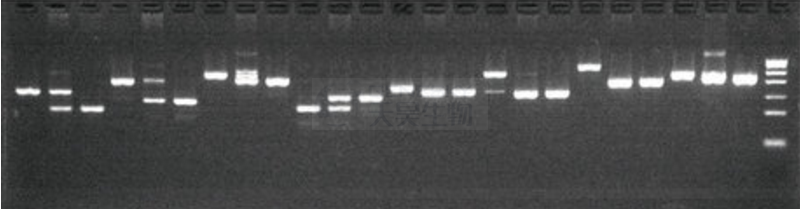
避免将非特异扩增条带误判为等位基因
传统电泳技术无法识别非特异扩增条带,容易把非特异扩增条带误认为是目标条带,导致等位基因判读错误,因为多倍体含有的等位基因条带较多,因此这种情况尤其严重,而SSRseq技术基于测序得到包含SSR位点序列在内的序列信息,将测序数据与参考序列比对,可以将非特异扩增序列过滤去除,然后对留下的目标序列进行分型。
您知道下图哪些条带才是目标条带?每个泳道有哪几种等位基因吗?
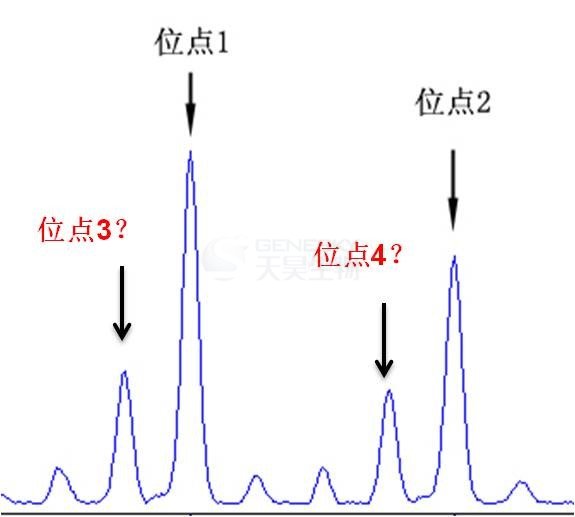
避免将滑移峰误判为等位基因
多倍体物种由于等位基因较多,无论是利用传统电泳还是荧光毛细管电泳进行分型时,容易将滑移峰误判为等位基因,而SSRseq技术可以通过生物信息学分析流程去除滑移数据,从而避免将滑移峰误判为等位基因,从而得到更客观的不同等位基因相互比例数据。
您知道下图红色标注部分是等位基因3,4,还是滑移峰?
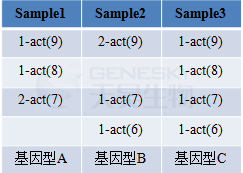
准确得到不同等位基因的相对比例
无论是传统电泳技术还是荧光毛细管电泳都无法通过电泳条带亮度或峰高比例准确计算不同等位基因间的相互比例,而SSRseq技术可以通过统计SSR标记中各个等位基因对应的reads数量,结合滑移校正和不同等位基因扩增效率校正,统计得到某个SSR标记中各个等位基因之间的相对比例,基于等位基因比例可以更准确地进行遗传多样性、遗传分化程度和遗传结构分析。
图4 上述表示四倍体物种通过SSRseq技术分型得到不同等位基因的相对比例。3个不同样本得到3种完全不同的基因型,表格内表示:不同等位基因的相对比例-SSR重复单元(重复数)。
不需要人工判读基因型,基于生物信息学分析流程高效、准确分型。
相对于传统技术,高通量、低费用。
局限性:
分型位点数和样本量较小时不适合,一般建议位点数不少于10个,样本量不少于100个
必须基于已知的染色体倍数才能得到不同等位基因间的相互比例
以上是小编为大家整理的动植物SSR分型技术汇总,每种技术都有各自的优劣势,看完后相信您在进行多倍体动植物SSR分型的时候,已经找到最合适您的那个它。
更多内容,请点击链接:
SSR究竟能干些啥
聊聊SSR•遗传多样性
聊聊SSR•遗传多样性(二)
SSR动植物中从事的三大行业

 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886