 ’
’
英文题目: Berberine improves colitis by triggering AhR activation by microbial tryptophan catabolites
中文题目:小檗碱通过调节微生物色氨酸分解代谢激活色氨酸受体(AhR)而改善结肠炎
期刊名: Pharmacological Research
炎症性肠病(IBD)是发生在胃肠道的一种反复发作的炎症性疾病,其发病机制复杂,目前临床治疗尚不理想。基本上,肠道屏障功能障碍是由肠道菌群失调引起的,与IBD的发展密切相关,因此我们研究了小檗碱(BBR)改善肠道菌群失调对大鼠IBD的治疗能力,采用靶向代谢组学和16S rDNA扩增子测序技术相结合的策略。值得期待的是,我们的数据显示,给予小檗碱(BBR)可以显著改善葡聚糖硫酸钠(DSS)诱导的结肠炎大鼠的病理表型、肠道屏障破坏和结肠炎症。此外,我们的代谢组学分析表明,在大鼠结肠炎的发展过程中,胃肠道中的微生物色氨酸分解代谢水平发生了显著变化,BBR治疗可以相应地显著恢复这种色氨酸分解代谢的变化。最后,我们用Caco-2细胞模型进行了体外机制的探索,验证了调节失调的肠道微生物群来改变微生物代谢产物协调了BBR对结肠炎肠道屏障破坏的改善作用,同时我们也证实了微生物代谢产物对色氨酸受体(AhR)的激活对于BBR对肠道屏障破坏的改善是必不可少的。总之,BBR通过调节肠道菌群相关的色氨酸代谢产物激活色氨酸受体(AhR),从而显著改善肠道屏障功能,从而治疗DSS诱导的大鼠结肠炎。重要的是,我们的发现阐明了BBR改善肠道屏障功能的一种新机制,在临床上有望促进BBR衍生药物的发现和开发。
大鼠随机分为:正常组(Nor)、UC组(colitis)、UC+40mg/kg BBR组(BBR)(每组8只)。UC模型是通过在饮用水中给予5%(w/v)葡聚糖硫酸钠(DSS)7天诱导的。BBR组灌胃给予溶于水的BBR 7天,同时对健康对照组和结肠炎大鼠灌胃等量水。每天监测体重和疾病活动指数(DAI),包括大便稠度和直肠出血。最后一天,采集粪便样本,分析肠道菌群组成和体外细菌培养。取新鲜脾脏和结肠组织进行称重和生物分析,包括组织学、ELISA、qRT-PCR和Western印迹分析。
用抗生素鸡尾酒(氨苄1克/升,新霉素1克/升,甲硝唑0.25克/升,万古霉素0.5克/升)去除肠道菌群,建立PGF(无菌)大鼠模型:PGF-UC:DSS给药前应用抗生素治疗7天,维持至实验结束;PGF-BBR:BBR治疗与上述相同(每组6例)。最后一天,粪便和血清样本储存在−80°C,直到需要进行代谢分析。新鲜取脾脏和结肠组织进行称重和生物分析,包括组织学、ELISA、qRT-PCR和Western印迹分析。
根据先前的研究,已建立的大鼠模型连续7天口服5%DSS可成功诱导大鼠急性结肠炎,表现为腹泻、虚脱、血便等与人IBD相似的表型。DSS给药2天后,结肠炎组的DAI评分(包括体重减轻、大便稠度和大出血)显著增加(图1A和B),并且在停止DSS刺激1周后仍然轻微升高。因此,在给药后第7天对模型大鼠进行BBR治疗。药物治疗组的DAI从第8天到第11天急剧下降,并在BBR治疗后第14天逐渐恢复到对照组的水平(图1B)。在DSS诱导的结肠炎大鼠中,作为结肠炎症的主要生物标志物,结肠的重量/长度比明显增加,符合预期,BBR治疗可显著降低结肠的重量/长度比(图1C-1和图1C-2)。作为结肠炎症的主要标志物,IBD患者常出现明显的脾肿大,脾脏重量被定义为全身炎症表型的一个指标。与我们先前的研究一致,DSS诱导的结肠炎大鼠脾脏增大,而BBR治疗可以显著减轻结肠炎大鼠的肿胀(图1D)。此外,MPO活性可决定中性粒细胞的积聚,我们发现,从DSS诱导的结肠炎大鼠分离的血清和结肠粘膜中MPO活性均显著增强,BBR治疗可显著减弱DSS诱导的MPO活化(图1E)。此外,远端结肠的组织学观察也显示粘膜中有炎性细胞浸润(图1F)。此外,在结肠炎大鼠的结肠中发现杯状细胞和上皮的丢失、变形的结肠隐窝和水肿(图1F),令人兴奋的是,BBR治疗在结肠隐窝结构、水肿减轻、粘膜损伤和炎性细胞浸润方面获得了显著的组织学改善(图1F)。

图1 BBR可改善DSS诱导的大鼠结肠炎的病理表型。
BBR可以抑制DSS诱发的结肠炎大鼠的结肠炎症和肠屏障破坏
于实验最后一天采集各组大鼠结肠组织,用ELISA检测炎性细胞因子(TNF-α、IL-1β、IL-6和IL-10),结果表明,DSS诱导的结肠炎大鼠体内TNF-α、IL-1β、IL-6等促炎细胞因子与健康对照组大鼠比较明显升高。此外,结肠炎大鼠结肠组织中的抗炎细胞因子IL-10较健康对照组显著降低,而BBR治疗能显著逆转促炎细胞因子的上调以及抗炎细胞因子的下调(图2A)。
肠道屏障功能主要由结肠组织中的细胞间TJ蛋白决定,包括ZO-1、occludin和claudin-1。在本研究中,DSS诱导的结肠炎大鼠结肠组织中ZO-1和occludin的mRNA表达显著降低,而claudin-1的mRNA表达无明显变化。BBR处理进一步显著增加ZO-1和occludin的mRNA表达,并轻度增加claudin-1的表达,但无显著差异(图2B)。为了证实基因的表达,我们用western blotting方法检测ZO-1和occludin的蛋白表达,结肠炎组ZO-1和occludin蛋白表达明显低于正常组,然后,BBR处理可显著逆转DSS诱导组中这两种蛋白的下调(图2C-1和2)。用FITC标记的葡聚糖(一种通透性示踪剂)评价各组肠屏障功能。从图2D可以看出,DSS给药可以显著增加葡聚糖-FITC的通透性,然而,与结肠炎组相比,BBR治疗的大鼠表现出较低的肠道通透性。
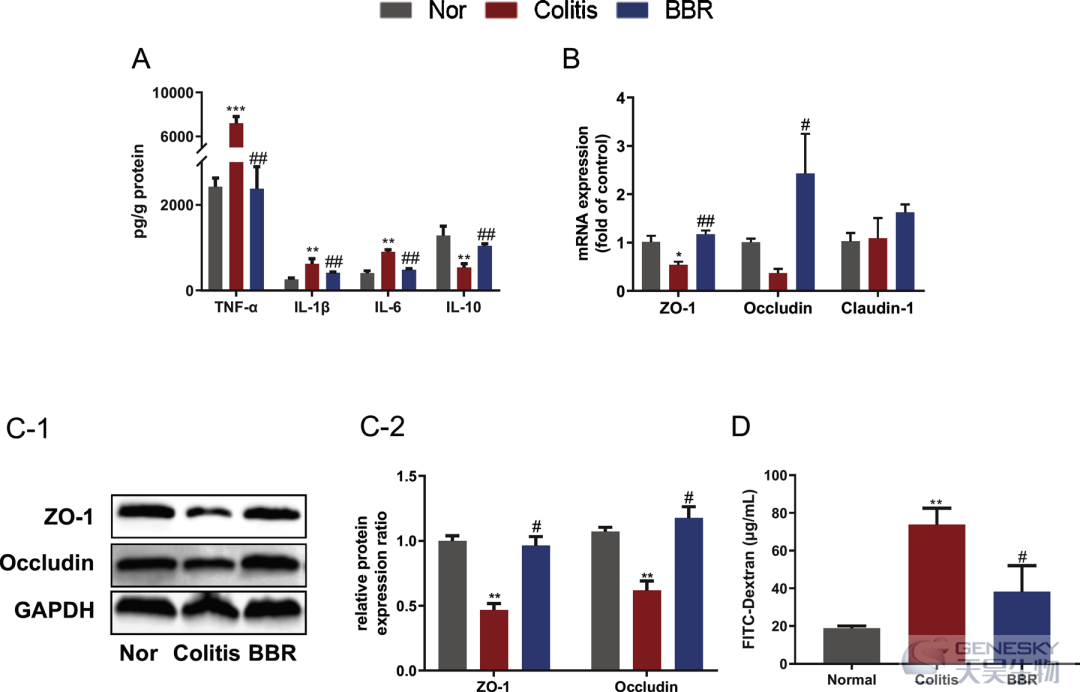
图2 BBR可改善DSS诱导的大鼠结肠炎的结肠炎症和肠屏障破坏。
BBR可以减轻DSS诱发的结肠炎大鼠的肠道菌群失调
通过对粪便细菌16S扩增子测序分析,分析了BBR对肠道微生物群的调节作用。结果表明,DSS诱导的结肠炎组和BBR治疗组的香农指数低于健康对照组(图3A),这与先前的研究一致。基于UniFrac的PCoA表明,尽管不同组的肠道微生物群之间没有明显的区别,但BBR治疗组和正常组之间的距离比结肠炎组和正常组之间的距离要近得多(图3B)。
进一步研究了门水平上的细菌分类学特征(图3C)。我们的数据表明,在所有样品中检测到9个门,其中Bacterioidetes、Firmicutes、Proteobacteria最为丰富。与正常组相比,结肠炎大鼠的Firmicutes相对丰度增加,Firmicutes/Bacteroidetes的比率更高,这与先前的研究完全一致。BBR处理可以通过降低Firmicutes的丰度和Firmicutes/Bacteroidetes的比率来稍微扭转这种趋势(图S5)。此外,我们还在属水平上研究了所有样品中肠道微生物群的变化(图3D和E),与对照组相比,DSS诱导的结肠炎组rc4.4和Ruminococcus的相对丰度显著降低,而Mycoplasma的相对丰度显著升高,结肠炎组Lactobacillus、Clostridium相对丰度呈下降趋势,与正常组无显著性差异。然而,通过BBR处理,这些细菌的比例恢复到正常水平。有趣的是,在DSS诱导的结肠炎组中,有益细菌Bacteroides、Akkermansia的丰度没有改变,而BBR处理可以显著增加两个属的表达水平。
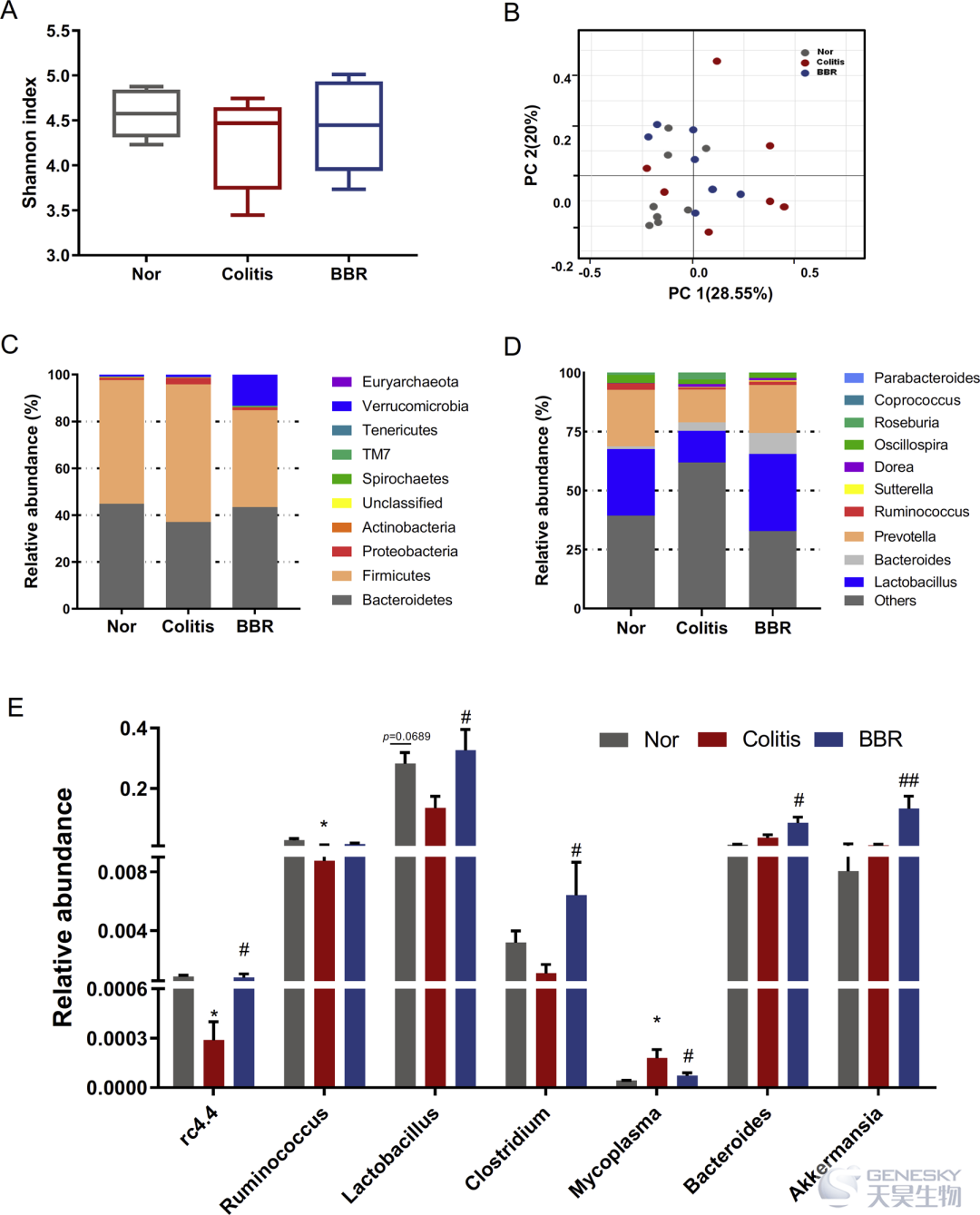
图3 BBR可减轻DSS诱导的大鼠结肠炎的肠道失调。
BBR可以以肠道菌群的依赖方式减轻DSS诱导的结肠炎
为了探讨BBR的治疗效果是否与肠道菌群的调节密切相关,我们首先用万古霉素、新霉素、甲硝唑和氨苄抗生素鸡尾酒治疗结肠炎大鼠和BBR治疗的结肠炎大鼠。与上述结果一致,BBR可以大大降低DAI,结肠的体重/长度比,脾脏重量/体重比,MPO活性以及结肠的组织学变化,而当肠道菌群被抗生素混合物耗尽时,BBR的治疗作用几乎消失了(图4A-F),这表明BBR可以治疗DSS诱导的结肠炎,其作用取决于肠道菌群。

图4 BBR可减轻DSS诱导的明显依赖肠道菌群的结肠炎。
BBR以肠道菌群相关色氨酸代谢为靶点,改善DSS诱导的大鼠结肠炎
肠道菌群对宿主的影响与一系列宿主-微生物的复杂相互作用密切相关,观察到小分子代谢物是协调这种相互作用的关键中间体,因此捕捉肠道微生物群调节的代谢物变化,使我们能够更好地理解BBR通过靶向肠道微生物群改善DSS诱导的大鼠结肠炎的生化机制。在这里,我们通过精确靶向代谢组学方法分析从不同组收集的粪便和血清样本的代谢物,通过该方法,我们试图描述与DSS诱导的结肠炎发展有关的差异代谢产物,以及与BBR治疗效率相关的差异代谢物。
关于血清代谢组学分析,在正常组和结肠炎组之间观察到显著的代谢分化,而BBR治疗有能力将DSS诱导的代谢分化恢复到正常组(图5 A),提示BBR通过调节代谢修饰对结肠炎有治疗作用。然而,当用抗生素鸡尾酒治疗大鼠时,我们发现BBR对结肠炎的代谢作用几乎减弱(图5A),这样的结果再次证实肠道微生物群在BBR调节的小分子代谢中起重要作用,以改善大鼠结肠炎。此外,观察到DSS给药可引发实质性代谢变化,与健康对照组相比,23种代谢物的水平显著降低(表S4),值得注意的是,BBR治疗可以将DSS诱导的结肠炎相关的14种代谢物的水平恢复到正常组的水平(图5C和表S4)。在粪便的代谢组,我们在三组中验证了相似的代谢修饰和调节作用(图5B), 与正常组相比,结肠炎组中有13种差异代谢物被确认显著增加(表S5),与结肠炎组相比,BBR治疗可将13种差异代谢产物的水平恢复至正常组的水平(图5D和表S5)。
总体而言,BBR通过靶向肠道菌群来调节大鼠结肠炎发展引起的差异代谢,从而提高了治疗效率。氨基酸代谢、核苷酸代谢和碳水化合物代谢是结肠炎发生和BBR治疗作用的主要原因。此外,色氨酸代谢主要受影响(图S6)。

图5 利用靶向代谢组学分析发现并鉴定关键的差异代谢产物。
在图6A中,DSS诱导的结肠炎组的血清色氨酸、N-乙酰-L-色氨酸、5-羟基-L-色氨酸、吲哚丙酸(IPA)、IAA和IA水平显著降低。BBR治疗可显著逆转这些血清代谢物的水平。DSS诱导的结肠炎大鼠的色氨酸水平显著升高,而与正常组相比,BBR治疗可使色氨酸水平恢复到正常组的水平(图6B)。此外,与正常组相比,结肠炎组粪便中的IPA、IAA和IA水平显著降低,BBR治疗可使其水平提高至正常组,但不提高IA水平。对于抗生素预处理的结肠炎大鼠,我们注意到在血清和粪便样本中,BBR对色氨酸代谢物的调节作用几乎被阻断(表S4和S5),这表明BBR通过调节肠道微生物群衍生的色氨酸代谢对DSS诱导的大鼠结肠炎具有治疗作用。
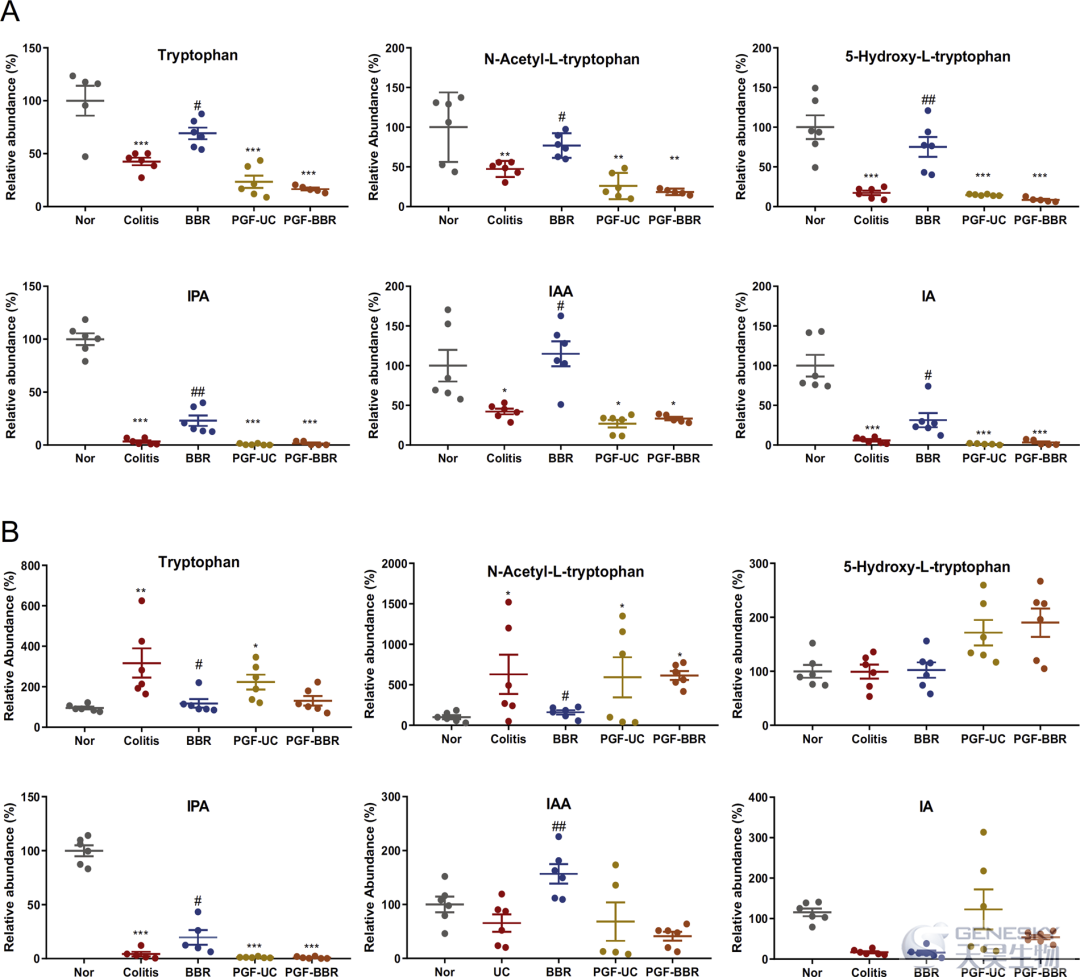
图6 在DSS诱发的结肠炎大鼠中,肠胃微生物群相关的色氨酸代谢大部分通过BBR处理而改变。
BBR可以增强色氨酸受体(AhR)活性并改善肠道屏障功能,并具有明显的肠道菌群依赖性
为了评价BBR如何调节肠道细菌对肠道屏障功能的影响,我们分析了对照组和治疗组的结肠TJ蛋白(ZO-1、occludin和claudin-2)、血清葡聚糖FITC浓度和结肠CYP1A1(AhR活性的指标)的表达。如图7A所示,ZO-1在结肠炎大鼠中的表达显著降低,而通过BBR治疗显著增加。Claudin-2蛋白在结肠炎大鼠中被发现显著上调,而BBR治疗可以显著下调这种蛋白,然而,这些由BBR调节的TJ蛋白的改变在鸡尾酒抗生素的预处理组中消失了。此外,在PGF(无菌)-结肠炎组和PGF(无菌)-BBR组中,由BBR调节的右旋糖酐FITC的下调均消失(图7B),表明BBR可改善肠道屏障功能,具有明显的肠道微生物群依赖性。此外,BBR治疗组中CYP1A1(AhR活性的指标)表达显著增加,而抗生素治疗组则没有这种上调,表明BBR通过调节肠道微生物群激活来色氨酸受体(AhR)。由于IL-22-/-小鼠表现出严重的肠上皮层损伤和AhR激活诱导的IL-22的产生,这已被证明对上皮层完整性很重要,我们测定了不同组结肠组织中IL-22的浓度,结果表明IL-22水平在DSS诱导的结肠炎大鼠中显著降低,BBR治疗可显著提高结肠炎大鼠中IL-22的浓度(图7C)。PGF(无菌)-结肠炎组和PGF(无菌)-BBR组中IL-22浓度无明显变化。综上所述,BBR可通过激活AhR活性保护肠道屏障功能而改善大鼠结肠炎,从而对肠道炎症有明显的改善作用,并具有明显的肠道菌群依赖性。
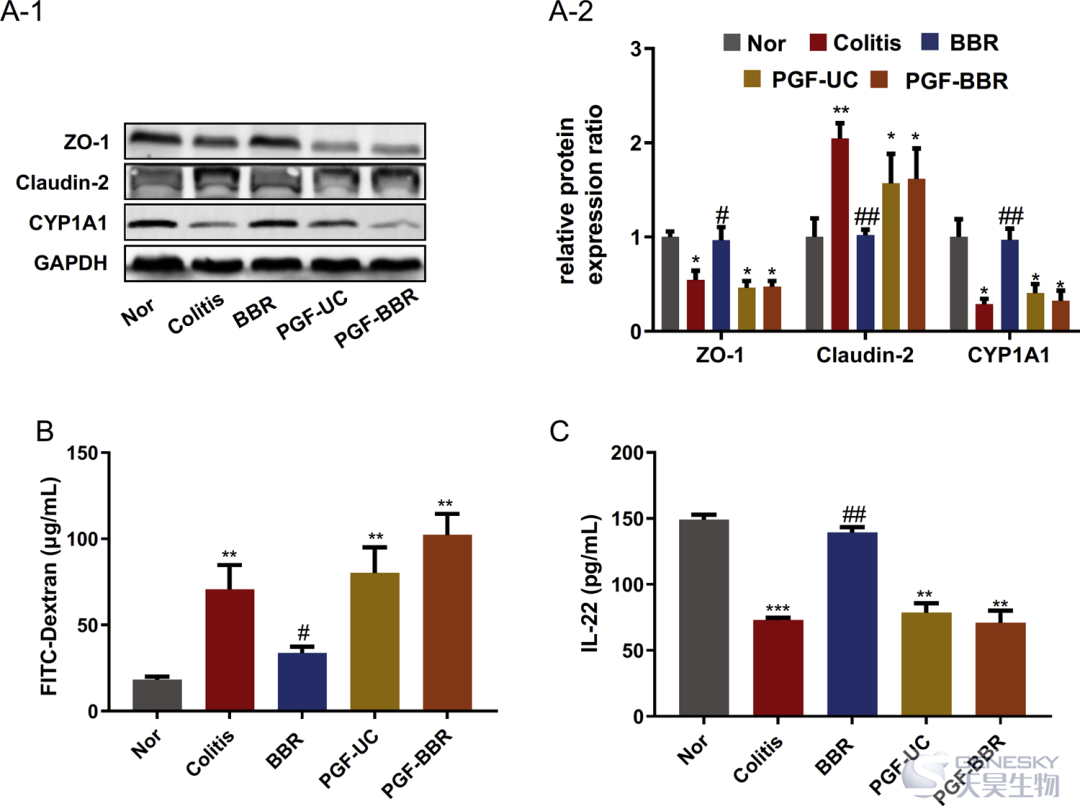
图7 BBR通过激活AhR维持DSS诱导的结肠炎大鼠肠道屏障功能,对肠道菌群具有明显的依赖性。
通过BBR治疗激活AhR,肠道微生物群的调节可解释肠道屏障功能的改善
为了证实BBR对肠道菌群的调节是否主要通过激活AhR来改善肠道屏障,我们将Caco-2细胞(Caco-2细胞模型是一种人克隆结肠腺癌细胞,结构和功能类似于分化的小肠上皮细胞)与从对照组和治疗组收集的肠道细菌培养上清液(CS)一起培养24小时。在结肠炎组CS处理后,Caco-2细胞中的TEER(跨膜电阻抗)显著降低;然而,BBR治疗组的CS可以显著改善结肠炎组CS引发的TEER降低(图8A)。然后我们检测了从不同组收集的肠道细菌对Caco-2细胞中ZO-1、occludin和claudin-2表达水平的影响,结肠炎CS处理24小时后,Caco-2细胞中ZO-1和occludin表达显著降低,claudin-2蛋白表达显著增加,用BBR-CS处理可以恢复这些蛋白质的表达(图8B)。与上述结果一致,结肠炎CS组Caco-2单分子膜中ZO-1和occludin的免疫荧光定位显示网状结构被破坏,部分不连续,而BBR-CS处理保留了ZO-1和occludin的定位。此外,用BBR-CS处理Caco-2细胞后,CYP1A1表达显著增加,提示AhR已被激活。
为了进一步研究AhR激活对肠屏障功能改善的影响,选择了AhR的siRNA。对照siRNA处理或AhR-siRNA处理的Caco-2细胞与从不同组收集的CS孵育24小时,结果表明,转染AhR siRNA后,AhR的表达降低了约80%(图8D)。在对照siRNA处理的Caco-2细胞中,结肠炎-CS组的AhR表达显著降低,与正常-CS组相比,BBR-CS组的AhR表达无明显改变,而令人惊讶的是,AhR-siRNA可以显著阻断BBR-CS对ZO-1和Claudin-2的改善作用(图8D)。
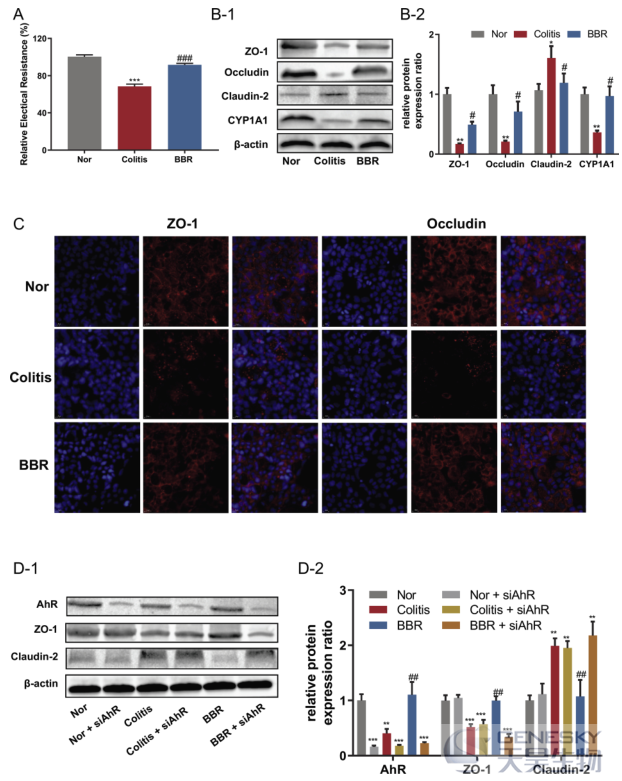
图8 BBR通过激活肠道细菌相关色氨酸代谢产物在Caco-2细胞中诱导的AhR来改善肠道屏障功能。
咨询沟通请联系
18964693703(微信同号)

创新基因科技,成就科学梦想

 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886
 ’
’







