
 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886

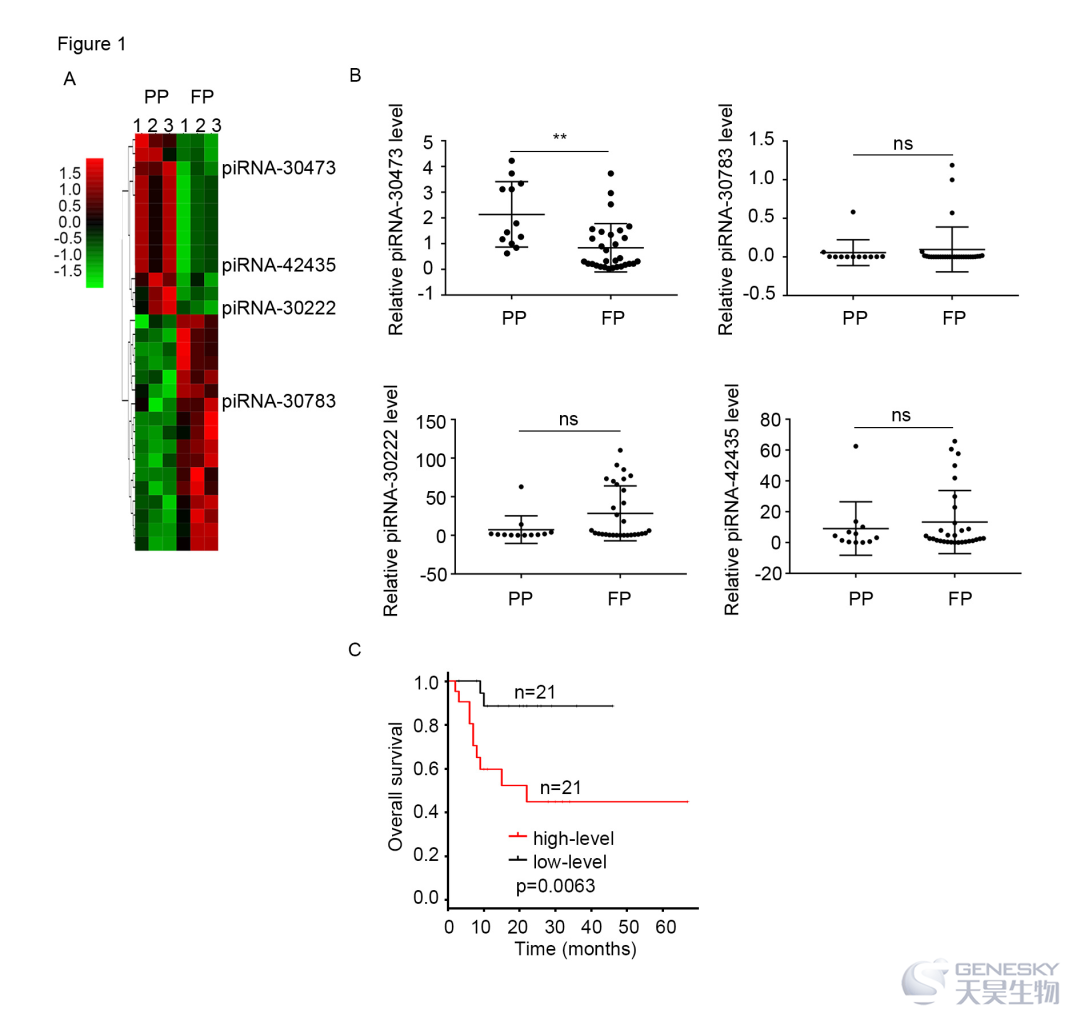









往期相关链接:
【昊文章】郑树森院士团队MC发文ALKBH5介导m6A影响肝癌进展;


创新基因科技,成就科学梦想
微信扫一扫
关注该公众号
前往“发现”-“看一看”浏览“朋友在看”