
 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886




为了确定TCF-1的丢失是否影响细菌入侵过程中IgA的产生,我们用李斯特菌感染模型检测了生发中心反应。在感染后第7天,对来自Tcf7−/−小鼠和同窝对照小鼠的Tfh和GCB细胞进行分析,我们发现Tcf7−/−小鼠的SPs和MLN中SLAM lo CXCR5+Tfh细胞的频率和数量显著减少(图S2A),Tcf7−/−小鼠中的PD-1 hiCXCR5+GC Tfh细胞也表现出显著减少(图S2B)。同时,来自Tcf7−/−小鼠的SP和MLN中的PNA+Fas+GCB在actA−LM-Ova激发下显著减少(图S2C),因此,与对照组相比,Tcf7−/−小鼠的SPs和MLN中CD138+CD19 lo PC的频率和数量也低得多(图S2D)。免疫组化分析进一步证实了Tcf7−/−小鼠SP和MLN的B细胞滤泡内受损的PNA+GCs(图S2E),结果,在没有TCF-1的情况下,粪便中抗原特异性IgA和IgG的水平显著降低(图S2F)。总之,这些结果表明TCF-1对Tfh细胞的分化以及在急性细菌感染时产生抗原特异性IgA的生发中心反应是必需的。
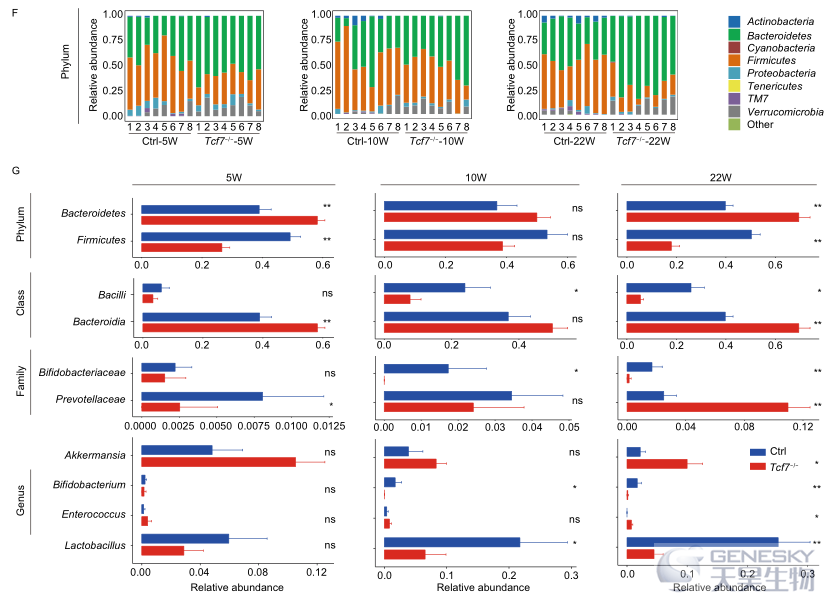
考虑到年龄是建立稳定肠道细菌组成的关键因素,选择5、10和22周龄的小鼠进行16S扩增子测序分析。通过加权Unifrac距离的主坐标分析(PCoA),发现不同年龄的Tcf7−/−小鼠的微生物群落都明显不同于其同窝对照组(图1E)。5周龄和22周龄Tcf7−/−小鼠的微生物多样性明显减少,然而在10周龄的Tcf7−/−小鼠中,没有统计学差异,尽管也表现出类似的趋势(图S3A)。与同窝对照组相比,Tcf7−/−小鼠的微生物群落中具有较多的Bacteroidetes和较少的Firmicutes(图1F)。我们进一步利用LEfSe分析在对照组和Tcf7−/−小鼠中发现了几个差异丰富的分支,例如,Tcf7−/−小鼠的促炎细菌(包括Prevotellaceae、Akkermansia、Enterococcus)水平升高,健康细菌(如Lactobacillus、Bifidobacterium)水平降低(图S3B和S3C)。此外,Tcf7−/−小鼠10周龄组在属水平上,Bacteroides(在拟杆菌门中占优势)增加,10周龄组和22周龄组在纲水平上,Bacilli(在厚壁菌门中占优势)减少(图1G)。为了检测分类群的协同效应,分别使用5周龄、10周龄和22周龄组的数据分析了对照组和Tcf7−/−小鼠之间富集OTU的丰度相关网络,正如预期的那样,对照样品中富集的OTU与Tcf7−/−小鼠富集的OTU呈负相关,这反映了Tcf7−/−小鼠肠道内容物中菌群的全部改变。同时,对照组或Tcf7−/−小鼠体内富集的OTU显示出正相关(图S3D)。我们的结果还表明,对照组和Tcf7−/−小鼠之间复杂性的改变与年龄有关。
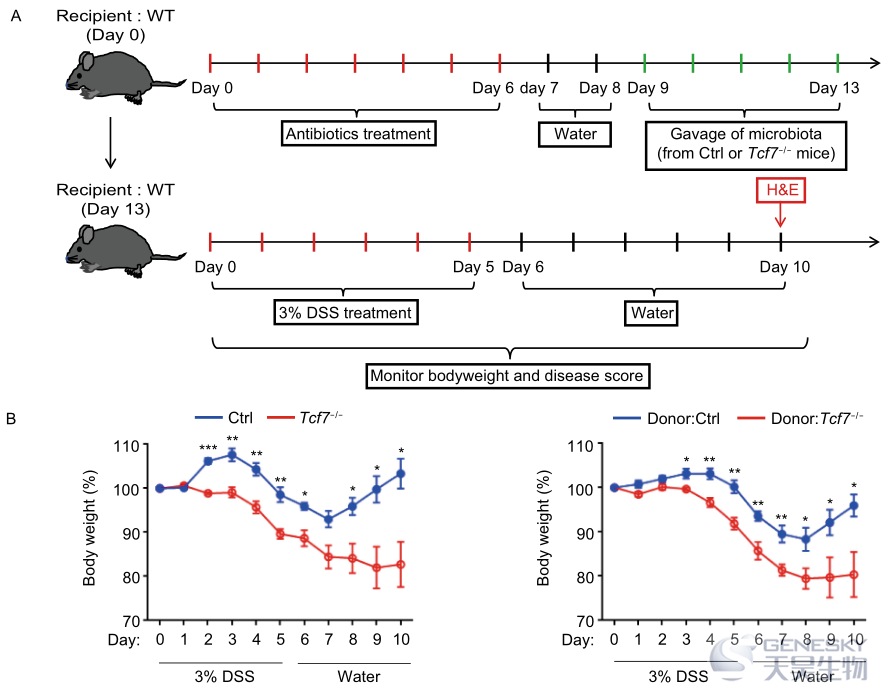
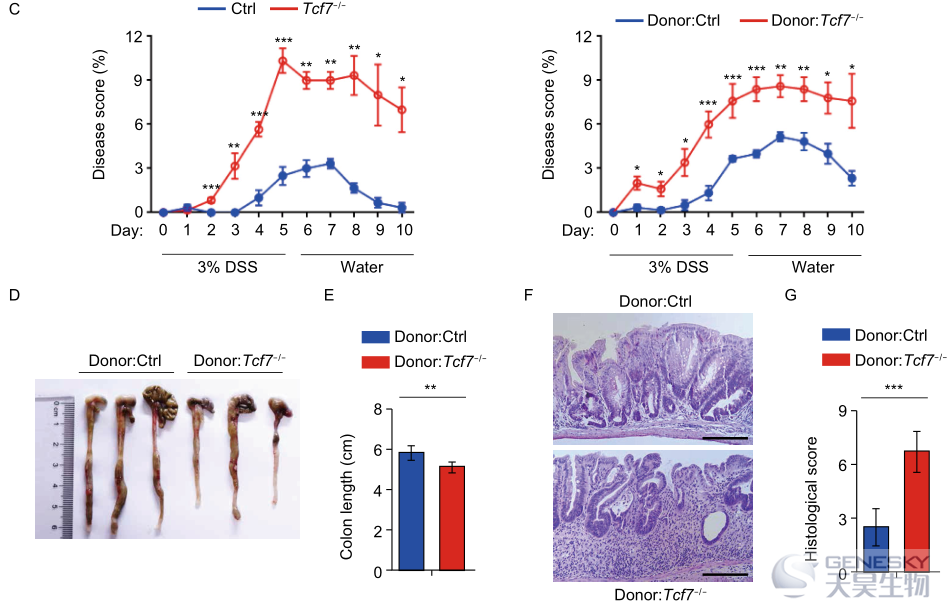
总之,使用不同年龄阶段的Tcf7−/−小鼠来评估TCF-1在肠道微生物群中的作用,并且16S rRNA扩增子测序数据反映了Tcf7−/−小鼠肠道细菌群落组成的紊乱。与同窝对照组相比,TCF-1缺失小鼠的PPs不明显,MLN变小,与生发中心反应缺失相关的GCB减少,从而导致IgA产生缺失和IgA结合细菌减少。因此,Tcf7−/−小鼠肠道细菌群落的失调与年龄有关,并有助于促进结肠炎症。因此,我们的结果揭示了以前未知的TCF-1在维持肠道菌群内稳态中的作用,并证明TCF-1缺失是导致肠道炎症的一个危险因素,对临床试验具有潜在的意义。
往期相关链接:
Pharmacological Research :小檗碱通过调节微生物色氨酸分解代谢激活色氨酸受体(AhR)而改善结肠炎;
Annals of Neurology :帕金森病肠道微生物生态系统:多组学的临床生物学新见解;
Nature Microbiology:火眼金睛,肠道菌群绝对定量分析擒“真凶”!;
Microbiome:肠道菌群ClpB基因功能与减肥和特征性微生物群有关;
Nature Microbiology:N-酰基乙醇胺可以使健康肠道菌群转化成类似IBD患者肠道菌群;
Gut:地中海饮食干预改变老年人肠道菌群从而降低衰弱状态和改善健康状况;
Nature Microbiology:肠道菌群重塑肠上皮细胞DNA甲基化以控制肠道稳态和炎症;
Nature Microbiology:厌氧消化链球菌促进结直肠癌发生及调节肿瘤免疫;

创新基因科技,成就科学梦想
微信扫一扫
关注该公众号