近期,m6A RNA甲基化相关的高分文章很多围绕m6A reader蛋白展开研究的,
本期就包含5篇以reader为中心的工作,
另外Nucleic Acids Research杂志新发布了两个RNA修饰相关的数据库。

胶质母细胞瘤是一种由胶质母细胞瘤干细胞(GSCs)驱动的普遍致死的癌症。这项研究通过甲基化RNA免疫沉淀测序(meRIP-seq)和转录组分析研究了GSCs中mRNA的m6A修饰,发现与正常神经干细胞(NSCs)相比,m6A标记的转录本常常上调。分析m6A调控因子,与NSCs相比,GSCs表现出m6A阅读器YTHDF2的优先表达,并表现出体外和体内的依赖性。虽然YTHDF2已被报道破坏mRNA的稳定,YTHDF2以m6A依赖的方式稳定了GSCs中的MYC和VEGFA转录。但本研究鉴定IGFBP3是GSCs中YTHDF2-MYC轴的下游效应因子。IGF1/IGF1R抑制剂linsitinib优先靶向表达YTHDF2的细胞,抑制GSC活性,但不影响NSCs和体内胶质母细胞瘤的生长。因此,YTHDF2连接了RNA表观转录组修饰和GSC生长,为YTHDF2-MYC-IGFBP3轴作为胶质母细胞瘤特异性的新靶点奠定了基础。

脑转移是癌症死亡的主要原因,但其分子机制研究严重不足。此外,关于m6A读蛋白YTHDF3在人类疾病中的作用还知之甚少。这一研究发现YTHDF3过表达在临床上与乳腺癌患者的脑转移有关。YTHDF3促进癌细胞与大脑内皮细胞和星形胶质细胞的相互作用,血脑屏障外渗,血管生成和生长。机制上,YTHDF3增强了富含m6A的转录产物ST6GALNAC5、GJA1和EGFR的翻译,这些都与脑转移有关。此外,脑转移灶中YTHDF3的过表达归因于基因拷贝数的增加和通过结合自身5’UTR内的m6A残基实现的自动调节YTHDF3帽子独立翻译。这项工作揭示了YTHDF3在控制癌细胞和脑微环境之间的相互作用,从而诱导脑转移的能力。

浙大医学院附属第一医院泌尿外科谢立平、郑祥义和王潇课题组在Molecular Cancer合作发文揭示YTHDF2基于m6A修饰介导前列腺癌中肿瘤抑制基因mRNA降解进而诱导AKT磷酸化作用。
背景:m6A是人类mRNA中含量最丰富的修饰。m6A参与各种疾病,特别是癌症。YTHDF2作为重要的解读器,通常通过m6A依赖的方式介导m6A修饰的mRNA的降解。然而,m6A特别是YTHDF2在前列腺癌(PCa)中的作用及机制尚不清楚。
方法:通过体外、体内生物学功能实验和表观遗传学手段探讨YTHDF2在PCa中的作用及其机制。利用慢病毒shRNA技术,建立了YTHDF2和METTL3的内源性表达沉默。细胞功能鉴定采用菌落形成、流式细胞仪和trans-well检测。采用皮下异种移植和转移小鼠模型,结合体内成像系统研究YTHDF2和METTL3敲低时的表型。m6A RNA免疫沉淀(MeRIP)测序、mRNA测序、RIP-RT-qPCR及生物信息学分析主要用于筛选和验证YTHDF2和METTL3的直接共同靶点。此外,还利用TCGA数据库分析了YTHDF2、METTL3和共同靶点LHPP在PCa中的表达模式及其与临床预后的关系。
结果:在PCa中上调的YTHDF2和METTL3预测较差的总生存率。抑制YTHDF2或METTL3在体内外均能明显抑制PCa的增殖和迁移。LHPP和NKX3-1被鉴定为YTHDF2和METTL3的直接靶点。YTHDF2直接结合LHPP和NKX3-1的m6A修饰位点介导其mRNA降解。敲除YTHDF2或METTL3可显著诱导LHPP和NKX3-1在mRNA和蛋白水平的表达,抑制磷酸化的AKT。过表达LHPP和NKX3-1表现出与敲除YTHDF2或METTL3时一致的表型和AKT磷酸化抑制。结果证实磷酸化的AKT是METTL3/YTHDF2/LHPP/NKX3 1的下游诱导肿瘤增殖和迁移的因子。
结论:这项研究提出了一种新的调控机制,在前列腺癌中,YTHDF2以m6A依赖的方式介导肿瘤抑制因子LHPP和NKX3-1的mRNA降解,调控AKT磷酸化诱导的肿瘤进展。希望这一发现能为PCa生物学提供新的概念。

西交利物浦大学生物科学系孟佳团队在核酸研究杂志上发表了新的数据库RMDisease,揭示遗传变异影响RNA修饰,并强调了与疾病的相关性(www.xjtlu.edu.cn/biologicalsciences/rmd)。
该数据库整合了18个不同的RNA修饰预测工具以及303,426个实验证实的RNA修饰位点,RMDisease发现了202,307个SNP位点可能影响8种类型的RNA修饰(m6A, m5C, m1A,
m5U, Ψ, m6Am, m7G和Nm)。这其中包括4,289个疾病相关的变异,这些变异可能暗示疾病发病机制在表观转录组层面发挥作用。这些SNP被进一步注释了一些基本信息,如转录后调控(miRNA结合的位点、与RNA结合蛋白的相互作用和选择性剪接),揭示了假定的调控回路。
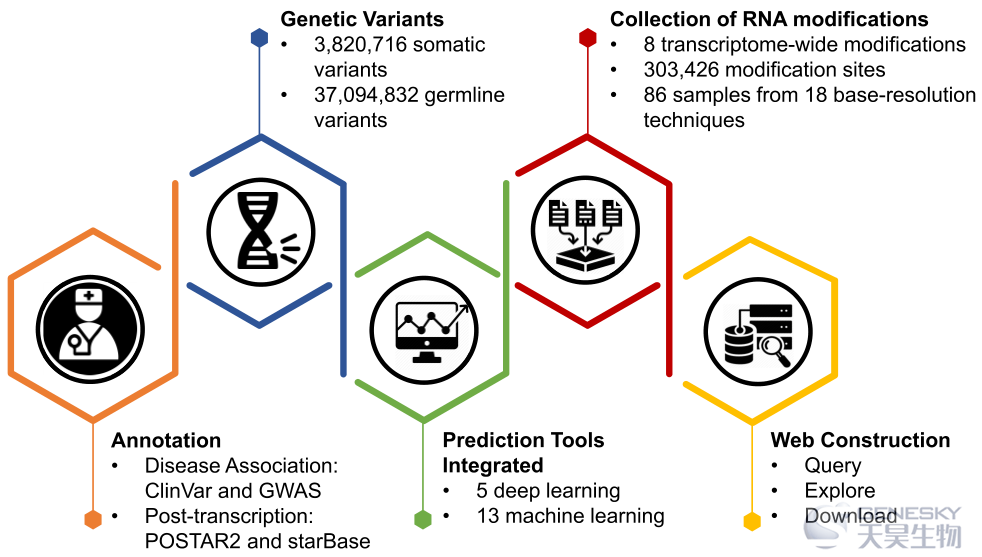

同期杂志中中山大学肿瘤防治中心左志向和任间团队合作对先前发布的数据库m6AVar进行了升级更新,重新命名为RMVar(http://rmvar.renlab.org)。
在这个升级版本的数据库中,包含了1678126个RNA修饰相关的变异,其中包含三种置信水平的9种RNA修饰类型,即m6A, m6Am, m1A, Ψ, m5C, m5U, 2’-O-Me, A-to-I及m7G。此外,还整合了RBP结合区域、miRNA靶标、剪接事件和环状RNA,以协助研究RNA修饰相关变异对转录后调控的影响。此外,从ClinVar和GWAS中整合疾病相关信息,以研究RNA修饰相关变异与疾病之间的关系。


10月5日,青岛大学转化医学研究院王昆教授团队在Nature Cell Biology发表题为“piRNA CHAPIR通过控制依赖于METTL3的Parp10 mRNA m6A修饰调控心肌肥大”的研究成果。再一次揭示了piRNA介导m6A甲基化转移酶影响下游靶点的m6A修饰进而参与疾病过程!(详见链接:第二篇!piRNA介导m6A修饰调控心肌肥大!)
这项研究发现了CHAPIR,一种肥大相关的piRNA,通过调节RNA m6A修饰来加速心肌肥大过程。机制上,CHAPIR通过与METTL3相互作用,阻断其RNA甲基化活性,从而抑制Parp10 mRNA的m6A修饰。这导致METTL3-YTHDF2依赖的Parp10 mRNA转录本降解被阻断,Parp10表达增加,进而抑制了GSK3β激酶活性,增加了NFATC4核积累和活性,NFATC4是一种参与肥大基因表达的转录因子。这项研究结果提出,CHAPIR是肥大反应的重要贡献者,它通过调节RNA表观遗传模块的活性和上调PARP10这一促肥大因子,从而影响着抗肥大分子如GSK3β蛋白的功能。

m6A修饰已经成为正常和恶性造血的重要调节因子。m6A mRNA解读器YTHDF2可以识别m6A修饰的转录本,从而促进m6A-mRNA降解,其失活会导致造血干细胞(HSC)扩增并损害急性髓系白血病。这项研究报道了YTHDF2缺失对HSC维持和多系造血功能的长期影响。实验证明,来自年轻小鼠的ythdf2缺陷造血干细胞在连续移植中失败,显示出多种m6A修饰的炎症相关转录本丰度增加,并长期激活促炎通路。与造血干细胞炎症通路的慢性激活的有害后果一致,造血特异性Ythdf2缺陷导致进行性骨髓偏倚、淋巴样潜能丧失、HSC扩张,以及老化的Ythdf2缺陷的造血干细胞无法重建多系造血功能。实验诱导的炎症会增加YTHDF2的表达,而YTHDF2是保护造血干细胞免受这种损伤所必需的。因此,这项研究将YTHDF2定位为HSCs炎症通路的抑制因子,并强调了m6A在HSC长期维持中的意义。

21世纪神经生物学的一个主要挑战是了解大脑如何适应经验。依赖于活动的基因表达是构成学习和记忆基础的突触可塑性的一部分;然而,这一过程不能用一个特定的神经元群体中简单的转录到翻译这一线性轨迹来解释。许多其他调节机制可以影响RNA代谢和神经元的适应能力。特别是RNA修饰m6A最近被证明可以通过选择性剪接、RNA稳定性和翻译来调节RNA加工。这篇综述系统地讨论了m6A还可以协调学习和记忆中关键mRNA的运输、定位和局部翻译这一新兴观点,并扩展了大脑中动态功能RNA状态的概念。m6A在大脑中特别丰富,被认为在轴突、树突隔间和激活的突触的RNA定位以及可能在RNA库的协调调节中发挥重要作用。

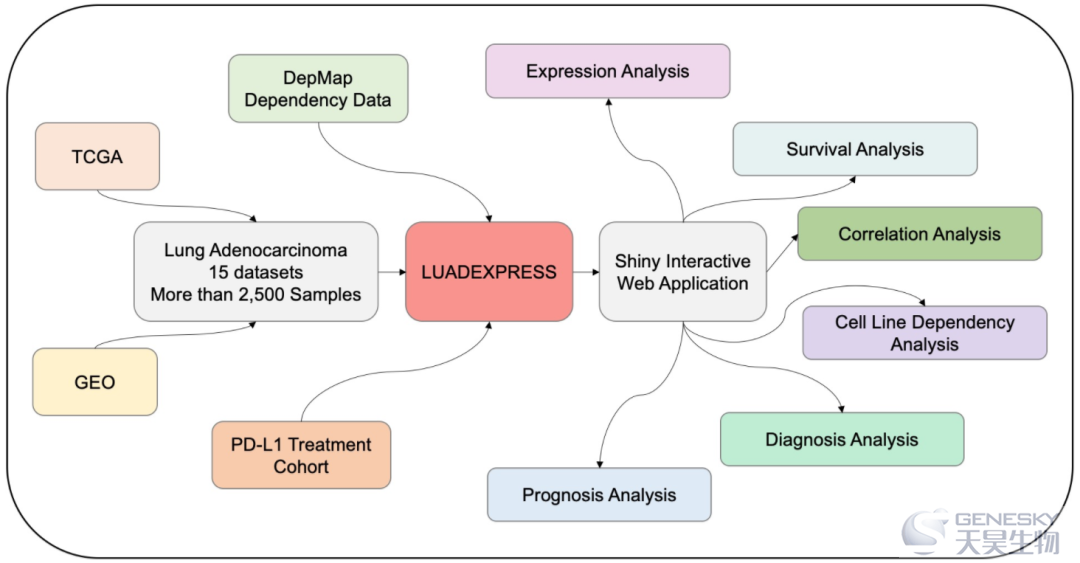
复旦大学附属中山医院胸外科卢春来团队系统地分析了多个肺腺癌样本数据中23个m6A 调控因子的分子特征、生物学功能、肿瘤微环境相关性及临床意义等,并建立了网站数据库(www.bioinfo-zs.com/luadexpress/)。
m6A修饰可以调控多种生物学过程。然而,m6A修饰在肺腺癌(LUAD)中的影响仍然很大程度上是未知的。这项研究通过分析23个m6A调控因子的多组学特征,系统地评价了2400多个LUAD样品中的m6A修饰特征。包括描述了m6A调控因子的遗传变异特征,发现FTO和YTHDF3的突变与较差的总体生存率相关。许多m6A调控因子在肿瘤中异常表达,其中FTO、IGF2BP3、YTHDF1和RBM15在11个独立队列中均表现出一致的变化特征。此外,调控通路相互作用网络显示m6A修饰与多种生物通路相关,包括免疫相关通路。同时评估了m6A调控因子与肿瘤微环境的相关性。结果发现LRPPRC与大多数肿瘤浸润性免疫细胞呈负相关。另一方面,研究人员建立了一种名为m6Sig的评分工具,该工具与PD-L1的表达呈正相关,可以同时反映LUAD患者的肿瘤微环境特征和预后。比较高、低m6Sig组的CNV发现7号染色体上存在差异。在抗PD-L1免疫治疗队列中应用m6Sig证实高m6Sig组具有治疗优势和临床效益。这项研究表明,m6A修饰参与了LUAD的多个方面,并有助于肿瘤微环境的形成。对m6A修饰的更好理解将为进一步了解LUAD的分子机制提供线索,并促进开发更有效的个性化治疗策略。

m6A是mRNA上最丰富的修饰之一,在各种生物过程中发挥着重要作用。甲基转移酶复合体(MTC)催化了m6A的形成,包含一个关键的甲基转移酶样因子3 (Mettl3)。但Mettl3和m6A修饰在肝脂质和糖代谢中的作用尚不清楚。该研究发现,在高脂饮食(HFD)诱导的代谢紊乱小鼠的肝脏中,Mettl3表达和m6A水平均升高。Mettl3的过表达加重了HFD诱导的肝脏代谢紊乱和胰岛素抵抗。与此相反,肝细胞特异性敲除Mettl3可通过减缓体重增加、减少脂质积累和改善胰岛素敏感性,显著减轻HFD诱导的代谢紊乱。机制上,Mettl3耗竭介导的m6A缺失导致代谢相关基因的RNA半衰期延长,从而保护小鼠免受HFD诱导的代谢综合征。这一发现揭示了mettl3介导的m6A在HFD诱导的代谢紊乱和肝源性糖尿病中的重要作用。

环状RNA(circRNAs)包括广泛而保守的一类RNAs,它们是由下游5’与上游3’剪接位点反向剪接而产生的。circRNAs是组织特异性的,与包括癌症在内的疾病有关。例如,其可以像海绵一样吸附miRNAs或RNA结合蛋白(RBPs)发挥功能。此外,一些包含开放阅读框架(ORFs)的circRNAs可以翻译。然而,这些多肽的功能相关性仍然很大程度上难以捉摸。这项研究报告了circZNF609的ORF在circZNF609过表达结构中被有效地翻译。但未检测到内源性蛋白。此外,尽管circZNF609存在m6A修饰位点,但是circZNF609翻译的起始不依赖于m6A生成酶METTL3或RNA序列元件,如内部核糖体进入位点(IRESs)。令人惊讶的是,全面的突变分析显示,构建产生circZNF609有缺陷的载体,但是仍然产生观察到的蛋白产物。这表明,circZNF609的明显翻译源于过表达质粒的反式剪接副产物,并强调了circRNA过表达构建需要仔细评估,尤其是在进行功能研究时。

哈尔滨医科大学附属肿瘤医院泌尿外科杜晨团队揭示了m6A参与前列腺癌进展的新机制。
背景:越来越多的证据支持赖氨酸特异性去甲基化酶5 (KDM5)家族成员起致癌驱动作用。本研究通过miR-495/YTHDF2/m6A-MOB3B轴阐明KDM5A对前列腺癌(PCa)进展的潜在影响。
方法:验证KDM5A、miR-495、YTHDF2和MOB3B在人PCa组织和细胞系中的表达。在PCa细胞中进行异常表达和敲除实验,以评估其对PCa细胞增殖、迁移、侵袭和凋亡的影响。对KDM5A、miR-495、YTHDF2和MOB3B的相互作用机理进行了双荧光素酶报告基因、ChIP和PAR-CLIP分析。采用Me-RIP法测定PCa细胞中MOB3B mRNA m6A修饰水平。建立了小鼠PCa细胞异种移植模型,监测肿瘤生长。
结果:KDM5A在人前列腺癌组织和细胞系中高表达。上调KDM5A可促进PCa细胞增殖、迁移和侵袭,但减少细胞凋亡。机制上,KDM5A作为H3K4me3去甲基化酶与miR-495启动子结合,导致其转录和表达受到抑制。YTHDF2作为miR-495的靶点,通过识别m6A修饰的MOB3B mRNA并诱导其降解,抑制了MOB3B的表达。此外,KDM5A还通过miR-495/YTHDF2轴下调了MOB3B的表达,从而在体外增强了PCa细胞的增殖、迁移和侵袭,在体内促进了肿瘤的生长。
结论:综上所述,这项研究强调了组蛋白去甲基化酶KDM5A活性在促进PCa进展中的潜力,并建议KDM5A为PCa治疗的一个有前景的靶点。
天昊生物具有多年基因组、转录组和表观组等多组学检测与分析的经验,m6A RNA甲基化作为表观领域的一大热点,天昊生物自主设计了m6A调控因子(writers/erasers/readers)差异表达分析检测panel,还可以提供m6A修饰整体水平定量检测,并结合MeRIP-seq和RNA-seq挖掘受m6A调控因子影响的下游靶点,同时可对相关的靶点进行MeRIP-qPCR验证。生信团队亦可提供个性化的m6A数据库挖掘与生信分析内容。
咨询沟通请联系
18964693703(微信同号)

创新基因科技,成就科学梦想

 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886

















