Nature Communication:动脉粥样硬化性心血管疾病患者肠道菌群宏基因组研究
首个大队列动脉粥样硬化人群宏基因组研究
英文题目:The gut microbiome in atherosclerotic cardiovascular disease
中文题目:动脉粥样硬化性心血管疾病患者肠道菌群宏基因组研究
期刊名:Nature Communication 发表时间: 2017.10 影响因子: 12.123
研究对象:
宏基因组测序:218例动脉粥样硬化性心血管疾病患者(ACVD)和187例健康对照者的粪便样本,PE100测序。去除低质量序列和人类DNA后,有2.2 Tb高质量序列(平均每个样本得到55.2M序列)能比对到肠道菌群参考基因集(含有9.9百万个基因),每个样本的序列平均有80.0 ±3.5%能够比对上。
研究背景:
心血管和代谢性疾病统称为心脏疾病(CMD),其具有高发病率和死亡率,并且耗费相当高的医疗费用。目前肠道微生物组已经成为影响人类健康和疾病的关键因素,心脏疾病也不例外。宏基因组学测序研究已经揭示糖尿病和肥胖患者肠道菌群特征。然而目前只针对很小样本量的心血管病患者进行了肠道菌群分析。以前的研究表明,肠道菌群代谢物胆碱,磷脂酰胆碱和L-肉碱能产生三甲胺(TMA),而三甲胺在肝脏中被氧化为三甲胺-N-氧化物(TMAO)。目前通过抑制依赖肠道菌群TMAO的产生被证明是一种治疗动脉粥样硬化
很有前途的策略。然而,CMD大型队列宏基因组学研究的缺乏严重阻碍了对微生物作用的进一步探索研究。
研究结果:
动脉粥样硬化性心血管疾病患者(ACVD)肠道微生物组成
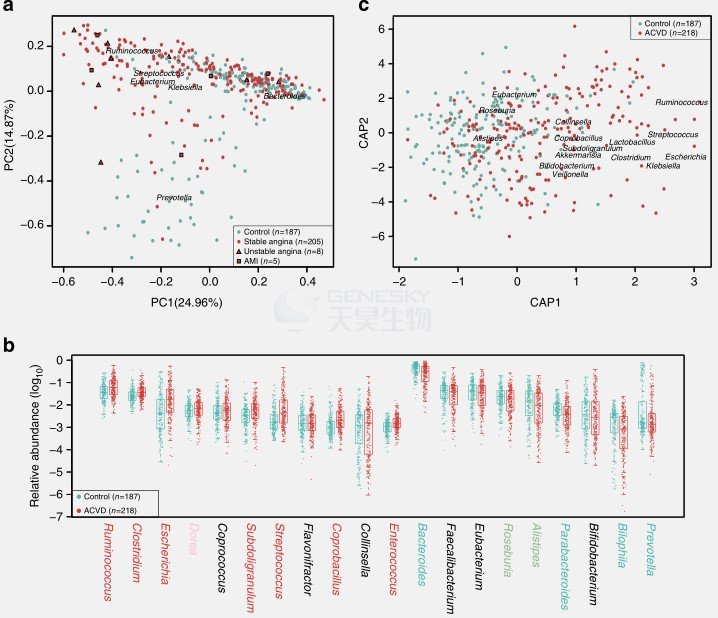
PCA和dbRDA分析表明健康组和ACVD患病组在一些主要菌属上存在明显丰度差异(图1)。例如Bacteroides和Prevotella在ACVD患者中减少,Streptococcus和Escherichia在ACVD患者中增加(图1B)。但是两组间在基因丰度和基因多样性没有明显差异。
图1. ACVD患者肠道主要菌群。A 属水平肠道菌群PCA分析。218个患者中有205个稳定型心绞痛、8个不稳定心绞痛、5个急性心肌梗死。B 前20个最丰富菌属的相对丰度,两组间有差异菌属用颜色标注。红色或青色, q-value <0.01; 浅红色或绿色, q-value <0.05; 黑色, q-value ≥0.05。C属水平肠道菌群dbRDA分析。
与ACVD相关的菌种和菌株
基于来自同一个微生物基因连锁的原则,根据基因丰度的共同变化将所有样本990万个基因聚集成为2982个MLG(MLG >100个基因)。这是目前为止基于丰度聚类得到的最大基因集,同时也是最大队列人群。组间共有536个丰度差异的MLG,占到所有MLG相对丰度的56.3%。其中320个MLG在ACVD患者中更丰富。
肠杆菌科细菌如Escherichia coli, Klebsiella spp.,和Enterobacter aerogenes在ACVD患者中丰度更高(图2)。
存在于口腔内的细菌,如Streptococcus spp., Lactobacillus salivarius, Solobacterium moorei, Atopobium parvulum在ACVD患者中比健康对照组丰度更高。
与炎症性肠炎和肠道微生物低丰度相关的Ruminococcus gnavus在ACVD患者中比健康对照组丰度更高。
以前报道过的能降低心脏病药物地高辛活性的Eggerthella lenta在ACVD患者中丰度更高
丁酸盐产生细菌包括Roseburia intestinalis和Faecalibacterium cf. prausnitzii在ACVD患者中丰度更低。
肠道常见细菌例如Bacteroides spp., Prevotella copri, Alistipes shahii在ACVD患者中丰度更低。
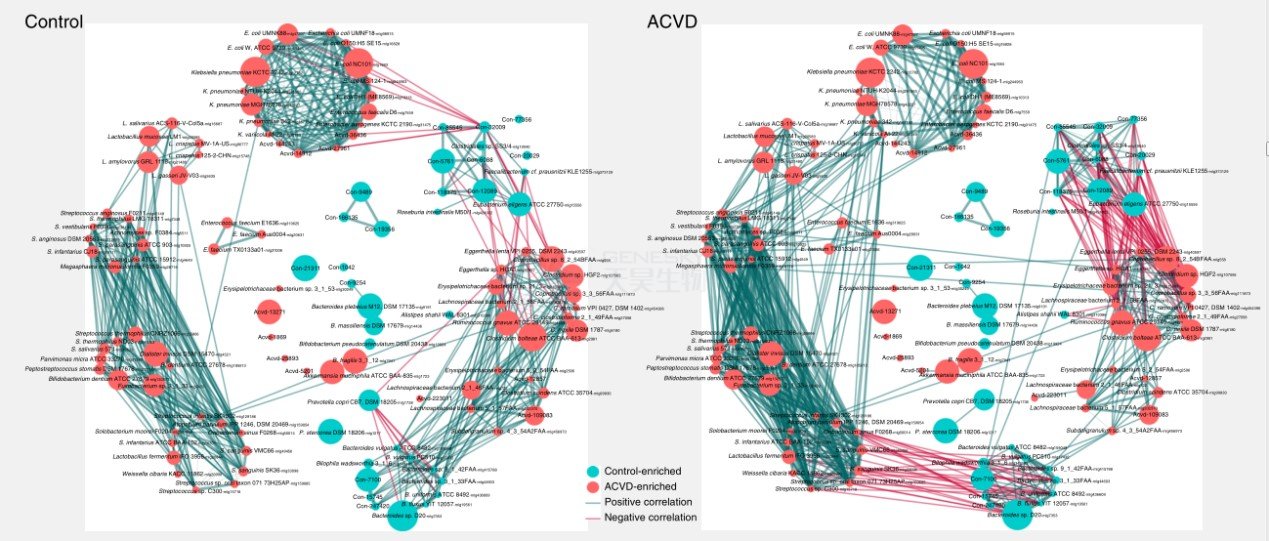
除了组间菌群丰度差异,组间MLG网络结构也有差异(图2)。
ACVD富集的厌氧生物 Streptococcus spp与ACVD减少的Bacteroides spp.呈负相关。
同时Streptococcus spp.与ACVD富集的Enterobacteriaceae呈正相关。
ACVD富集的Eggerthella spp., R. gnavus, Clostridium spp.,Erysipelotrichaceae bacterium, Lachnospiraceae bacterium与ACVD减少的产丁酸细菌Eubacterium eligens, F.prausnitzii, Clostridiales sp. SS3/4呈负相关。
图2. ACVD患者和对照者中组间有显著差异(q-value <0.05)的MLG((>100 genes))关系网络图。红色节点代表ACVD中富集;青色节点代表对照者富集。节点的大小表示该MLG的基因数量。线的粗细用Spearman相关系数值代表:粗线, |cc|>0.7; 中度线, 0.5<|cc|<0.7; 细线, 0.3<|cc|<0.5。绿线,正相关;红线,负相关。
肠道微生物和临床特征之间的联系
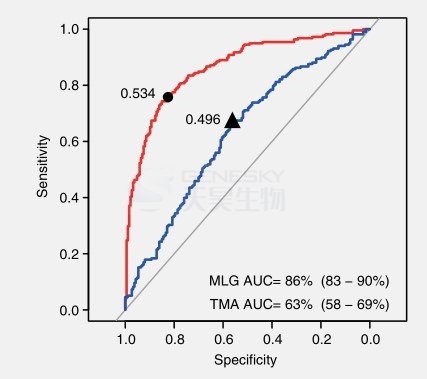
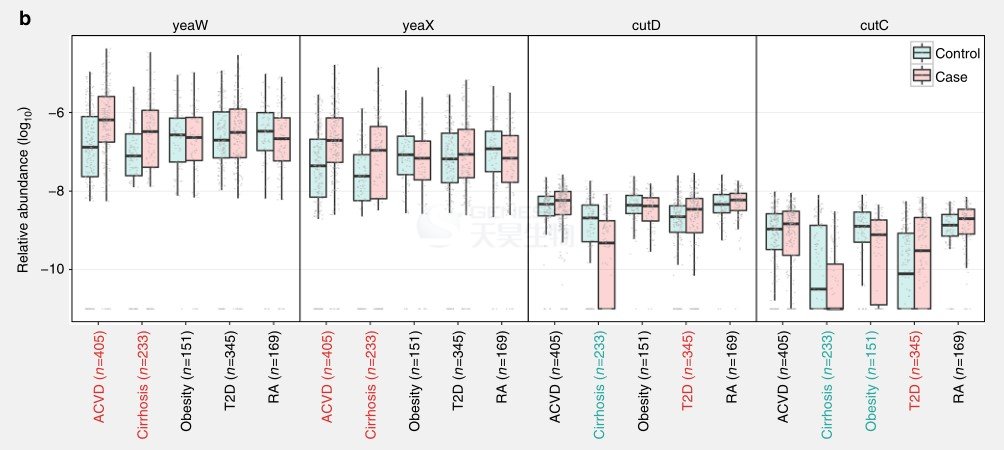
使用得到的MLG构建了一个随机森林分类器(图3)。ACVD患者的AUC值为0.86,这个数字要高于使用TMA裂解酶(CutC/D and YeaW/X)(图3)得到的AUC值(0.63),这表明除了TMAO还有其它因素影响ACVD。以前研究发现ACVD富集编码胆碱-TMA裂解酶(CUTC)的细菌,如Erysipelotrichaceae bacterium, C. nexile和S. anginosus(图2)。除了TMA裂解酶,一些毒力因子在这些细菌中也可能发挥作用,如免疫原性脂蛋白A IlpA, PhoP,phoQ / PhoP双组分系统,可以部分被宿主抗菌肽诱导。
图3.基于肠道微生物建立的疾病诊断模型。基于405份样本MLG构建的随机森林分类器的ROC曲线(红色)。括号内表示95%的置信区间。蓝线表示基于TMA裂解酶(CutC/D, YeaW/X)构建的ROC曲线。
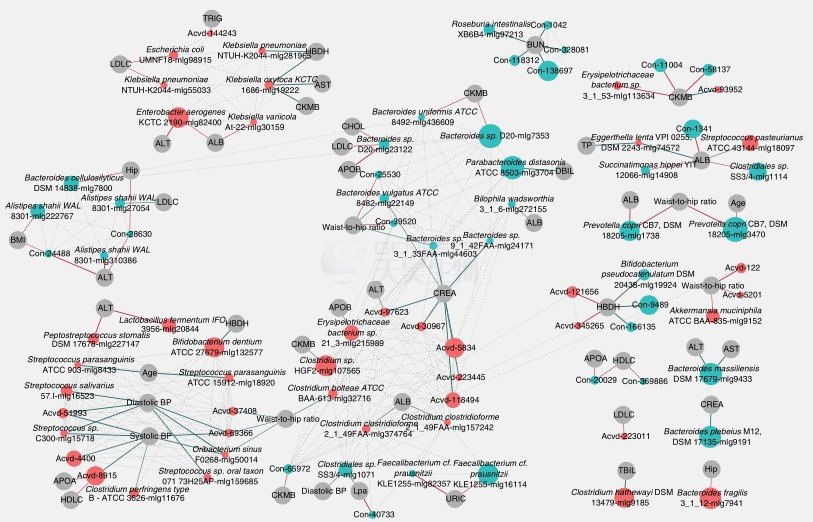
除了区分健康认和ACVD患者,MLG与一系列临床指标相关(图4)。
ACVD患者富集的K. oxytoca与血清AST(急性心肌梗死标志物)、α-羟基丁酸脱氢酶(HBDH)、肌酸激酶同工酶(CKMB)正相关。
Klebsiela pneumoniae,Bifidobacterum dentium与HBDH正相关。
ACVD富集细菌包括Streptococcus sp. C300, Streptococcus sp. oral taxon 07173H25Ap, S. salivarius, Oribacterium sinus, Clostridium perfringens与舒张压或收缩压呈正相关。
ACVD减少的F. cf. prausnitzii与血清中尿酸含量负相关,据报道饮食过多红肉后血清中尿酸含量增加,而进行DASH 饮食(停止高血压的一种膳食方法)会降低血清中尿酸含量。
Clostridium hathewayi与总胆红素TBIL相关。
图4. ACVD患者富集或减少的MLG与临床指标相关性。ACVD富集的MLGs用红圈表示,对照组富集的MLGs用青色圆圈代表。每个圆圈的大小表示这个MLG包含的基因数。线的粗细用Spearman相关系数值代表。绿线,正相关;红线,负相关;灰色虚线表示对照组样本MLG之间的相关性。
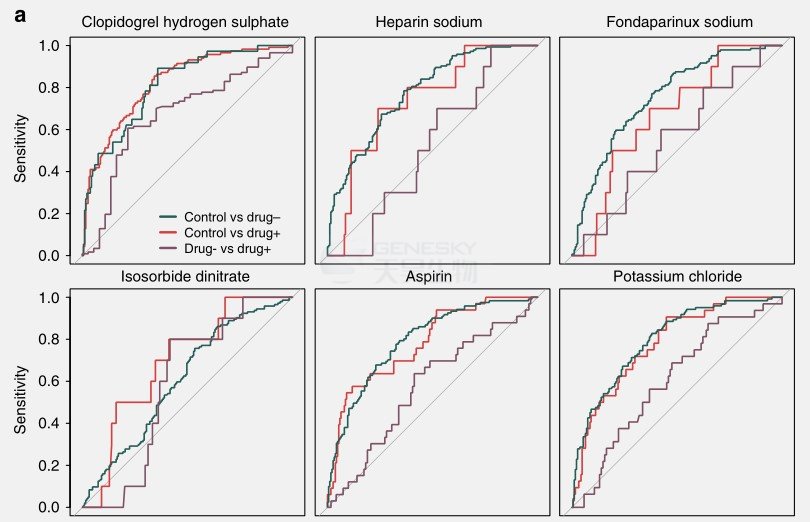
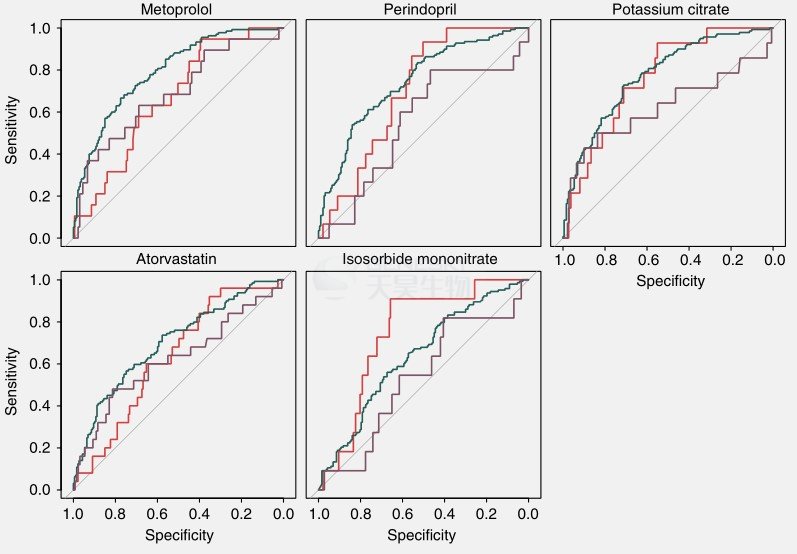
药物对肠道菌群的影响
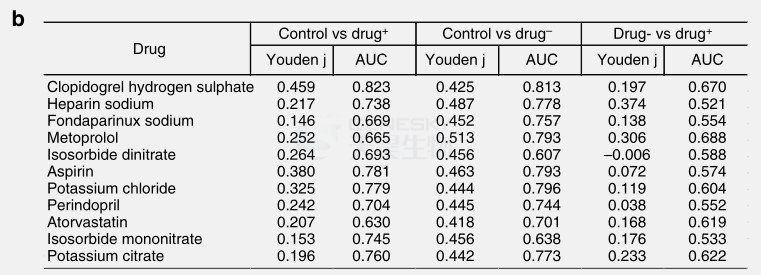
PERMANOVA分析表明磺达肝癸钠、糖尿病药物阿卡波糖、β-肾上腺素受体阻滞剂美托洛尔对肠道微生物基因丰度的显著影响,而阿托伐他汀(立普妥)对肠道微生物基因丰度有相对程度的影响。使用随机森林方法能将ACVD患者(用药或未用药)与对照组分开,并且AUC较高(图5A)。当两种药物一起分析而不是单个药物分析时,区分ACVD患者(未用药)与对照组的AUC值相对于ACVD患者(用药)与ACVD患者(未用药)的AUC更高,而区分ACVD患者(用药)与对照组的AUC值相对于ACVD患者(未用药)与对照组的AUC更低,这意味着如果患者队列中没有药物治疗,组间区别更加明显,这些结果表明,急性脑血管疾病状态,而不是用药是鉴别患者群体的主要特征。
此外,本文使用MaAsLin调查了药物使用对肠道菌群特定成员的潜在影响:3个MLG与美托洛尔使用呈正相关,2个MLG与阿托伐他汀使用呈正相关。另外,药物使用并未使ACVD相关菌株或菌种复杂化。
图5. ACVD患者用药处理随机森林表现。A. 使用随机森林方法能将ACVD患者(用药或未用药)与对照组分开。B. ROC曲线的AUC和约登指数。
ACVD患者肠道菌群功能改变
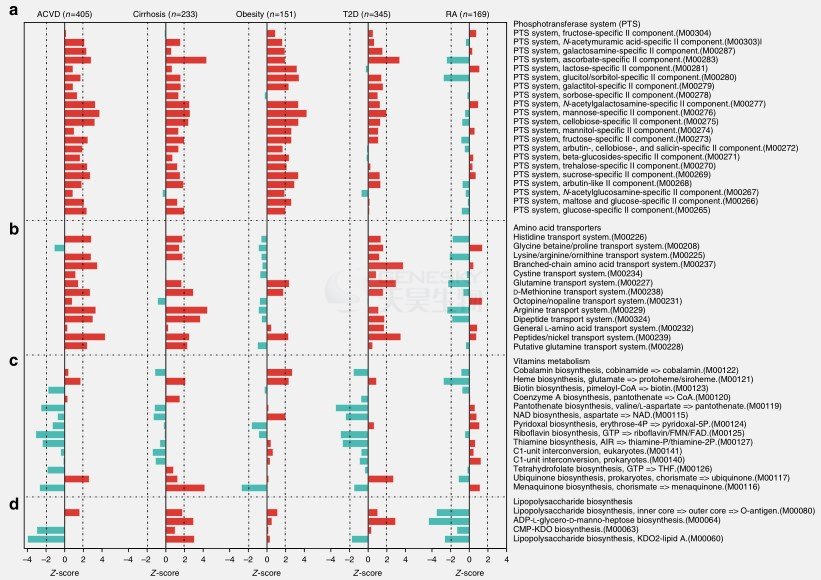
ACVD患者具有更高单糖和氨基酸运输水平(磷酸转移酶系统PTS),而维生素生物合成水平更低(图6,7)。
ACVD患者具有降低的四氢叶酸合成能力,因此影响同型半胱氨酸代谢(叶酸由于参与同型半胱氨酸代谢导致其在心血管疾病中起作用)。
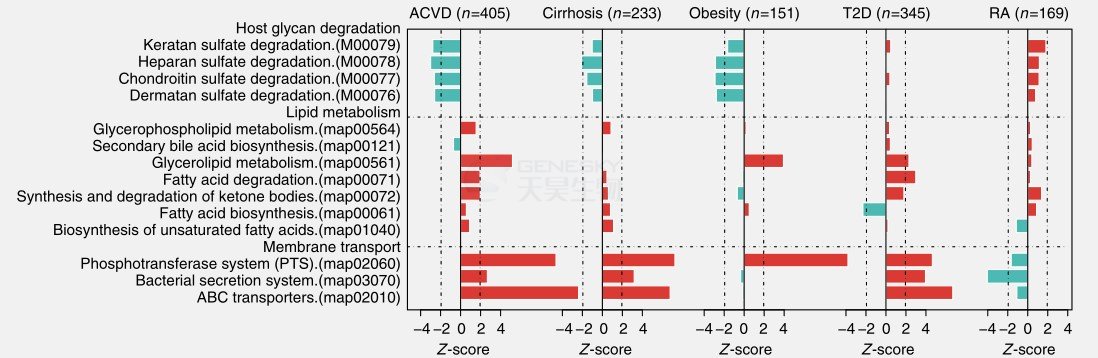
ACVD患者多糖(例如glycosaminoglycans)代谢减弱(图7)。
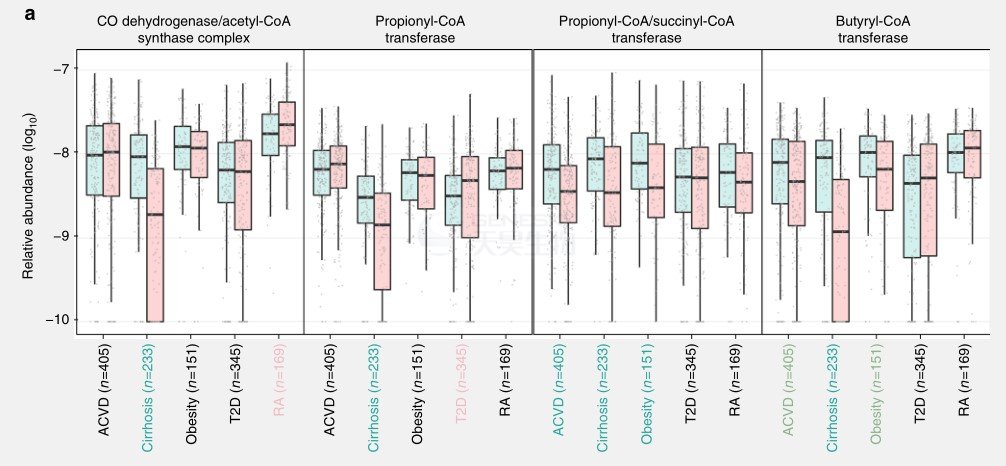
ACVD患者的甘油脂代谢和脂肪酸降解升高(图7),而抗炎性短链脂肪酸(SCFA)降低(图8)。
ACVD患者的合成乙酸途径没有显著变化(图8A),但是TMA裂解酶得到富集(图8B)。
ACVD患者的丙酮酸甲酸裂解酶更多,导致会产生更多的甲酸盐,从而导致高血压。
接着和其他疾病组(CMDs,obesity,T2D,RA)数据进行了横向比较:ACVD患者的MGL Streptococcusspp在肝硬化患者中富集,而Eggerthella并不多。ACVD中富集的E.coli MLGs在其他疾病case-control之间并无差异,说明一些特异或者常见的菌群可以用于诊断ACVD。
图6. ACVD和其他疾病肠道微生物功能模块的改变。A.PTS传输系统; B. 氨基酸转运蛋白; C. 维生素代谢; D. 乳酸生物合成。红色,患者富集;青色,对照者丰富。
图7. 膜转运途径、脂质代谢途径和宿主糖降解模块的差异富集。红色,患者富集;青色,对照者丰富。
图8. ACVD和其他疾病肠道微生物特异功能模块的改变。A.合成SCFA的酶。B. 合成TMA的酶。红色,患者富集;青色,对照者丰富。
基于特征微生物的CMDs和肝硬化鉴别
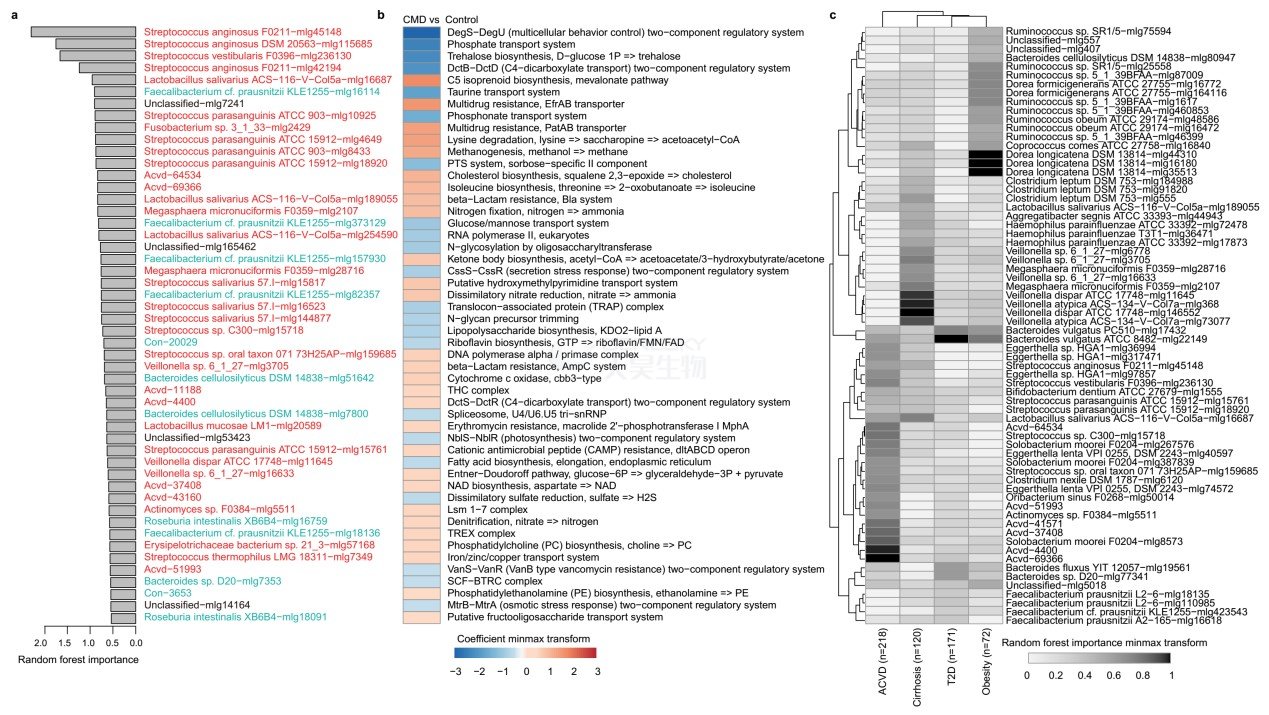
因为三种CMD(ACVD、糖尿病、肥胖)和肝硬化的肠道微生物功能具有比较高的相似性,因此就想能否找到筛选CMDs/肝硬化的MLGs与功能。在50个确定物种中,包括ACVD富集的MLG,如S. anginosis, S. vestibularis, L. salivarius和ACVD中减少的MLGs,如F. cf. prausnitzii, Bacteroides cellulosilyticus, R.intestinalis用来作为筛选ACVD患者(补充图9A)。同时,可以基于KO建立LASSO模型用来筛选ACVD患者(补充图9B),CMDs/肝硬化中排名第一的KO是ACVD中较低的DegS-DegU系统,它可以触发生物膜的形成以应对鞭毛的旋转不畅。ACVD中较低的牛磺酸转运系统在CMDs/肝硬化模型中也很重要。
CMD与肝硬化菌群特征很相似,那么能否找到区分每种CMD或者肝硬化的特征微生物呢?
结果发现Veillonella spp.是鉴别肝硬化的最重要特征菌,B. vulgatus是鉴别二型糖尿病的最重要特征菌,Dorealongicatena是鉴别肥胖的最重要特征菌(补充图9C)。两种未分类物种(Acvd-4400 and Acvd-69366)能区别ACVD与其它两种CMD。这是首次使用特征菌区分多种疾病类型。
补充图9 基于特征微生物的CMDs和肝硬化鉴别。A.筛选CMD患者的重要MLG。红,ACVD富集;青色,对照组富集;黑色,无显著性差异。B. 筛选CMD患者的重要KO。C. 筛选每种类型CMD的MLG。
总结:
本研究是世界首个大队列ACVD宏基因组研究,利用MLG构建的诊断模型可以用来对ACVD人群进行诊断;
ACVD 患者中Enterobacteriaceae和Streptococcus显著增加,对心血管健康比较重要的几个分子的代谢或运输功能也显著富集。
虽然药物治疗是一个混杂因素,但急性脑血管疾病状态,而不是用药才是鉴别患者群体的主要特征。
通过比较宏基因组数据找到区别3种CMD和肝硬化的特征菌。

 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886