英文题目:Association between methylation of BIN1 promoter in peripheral blood and preclinical Alzheimer’s disease
中文题目:外周血中BIN1启动子的甲基化与临床前阿尔茨海默病的关系
发表单位:青岛大学附属青岛市立医院神经内科+复旦大学附属华山医院神经内科

近日,青岛大学附属青岛市立医院神经内科谭兰教授携手复旦大学附属华山医院神经内科郁金泰教授团队的研究成果发现,外周血中BIN1基因启动子的低甲基化与临床前AD的相关表型显著相关,提示BIN1低甲基化对AD病理的影响可能发生在非常早期的阶段,这对于AD的早期干预和预防尤为重要。该文章近期发表于精神病学专业期刊《Translational Psychiatry》上。天昊生物有幸承担了外周血样本的BIN1基因甲基化检测和生信分析工作。
背景:桥连整合因子1(BIN1) 基因是仅次于ApoE的晚期阿尔茨海默病(LOAD)最重要的易感基因。
方法:为了探讨外周血中的BIN1甲基化是否在LOAD的早期阶段发生变化,研究者纳入了中国阿尔茨海默病生物标志物和生活方式(CABLE)数据库中的814名参与者(484名认知正常的参与者[CN]和330名主观认知能力下降的参与者[SCD])。作者分析了外周血中BIN1启动子的甲基化与临床前AD的易感性和脑脊液(CSF)中AD相关生物标志物的早期变化的关系。
结果:SCD组具有显著的AD生物学特征,其BIN1启动子的甲基化水平较低,即使在校正了协变量后也是显著低于CN组。在总样本中,BIN1启动子的低甲基化与CSF Aβ42的减少有关(p=0.0008),也与p-tau/Aβ42(p=0.0001)和t-tau/Aβ42(p<0.0001)的增加有关。亚组分析显示,上述关联仅在SCD亚组中存在。此外,在SCD亚组中,BIN1启动子的低甲基化还伴随着CSF p-tau(p=0.0028)和t-tau(p=0.0130)的增加,且相关性独立于CSF Aβ42与甲基化的相关性。最后,在校正了单核苷酸多态性位点(SNP)的影响和APOE?4状态的交互作用后,上述关联仍然显著。
结论:本研究首次汇报了外周血中BIN1启动子的低甲基化与临床前AD之间的关系。这为BIN1参与AD提供了新证据,并可能有助于发现新的AD治疗靶标。
◆阿尔茨海默症(AD)是一种复杂的、多因素参与的神经退行性疾病,被认为具有高度的遗传性。
◆AD全基因组关联研究(GWAS)的应用,加速了AD易感基因的发现,这其中即包括GWAS新发现的AD重要易感基因---桥连整合因子1(Bridgingintegrator 1,BIN1)。BIN1基因是仅次于ApoE的LOAD最重要的易感基因。
◆BIN1在许多组织中广泛表达,并在AD脑中观察到BIN1过量表达。然而,仅仅是基因突变似乎并不能完全解释BIN1在AD患者中的异常表达。因此,研究人员开始把重点放在其表观遗传学机制上。
◆两项独立的大型尸检研究显示,AD患者大脑中的BIN1存在甲基化变化,同时伴有BIN1的高表达。然而,BIN1的甲基化变化是否也存在于外周血中,以及它们是否与LOAD患者的早期病变有关,仍是未知数。
●样本来源:中国阿尔茨海默病生物标志物和生活方式(CABLE)数据库中的814名参与者。814名参与者均不满足轻度认知功能障碍(MCI)和AD的诊断标准,且没有客观的认知障碍。SCD是通过主观认知衰退量表(SCDS)来评估的,该量表是根据SCD-I建议设计的。我们通过SCDS的第一部分(包括一个二分法问题)将SCD患者从没有客观认知障碍的参与者中区分出来。最后,我们得到了484名认知正常的参与者[CN]和330名主观认知能力下降的参与者[SCD]。
●信息和样本采集:所有参与者都有完整的信息,包括年龄、性别、受教育年限、CM-MMSE、APOE ε4状态、外周血BIN1启动子的甲基化水平,以及CSF中AD核心生物标志物的水平:包括淀粉样β42(Aβ42)、总的tau蛋白(t-tau)和磷酸化的tau蛋白(p-tau)。还收集了每个参与者的外周血细胞计数(嗜中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞和嗜碱性粒细胞)。
●外周血BIN1启动子的甲基化水平检测:采用天昊生物MethylTarget®多重目的区域甲基化富集测序技术,从BIN1基因的CpG岛中选择了六个区域(BIN1_01-06)并进行测序。
● 基本信息分析:SCD组样本的年龄高于CN组(p < 0.0001);与CN组相比,SCD群体有较低的Aβ42水平(P=0.0004)、较高的 p-tau/Aβ42(p<0.0001)和t-tau/Aβ42(p<0. 0.0001)水平(表1),这提示本研究中的SCD人群已经具有了临床前AD的病理特征。
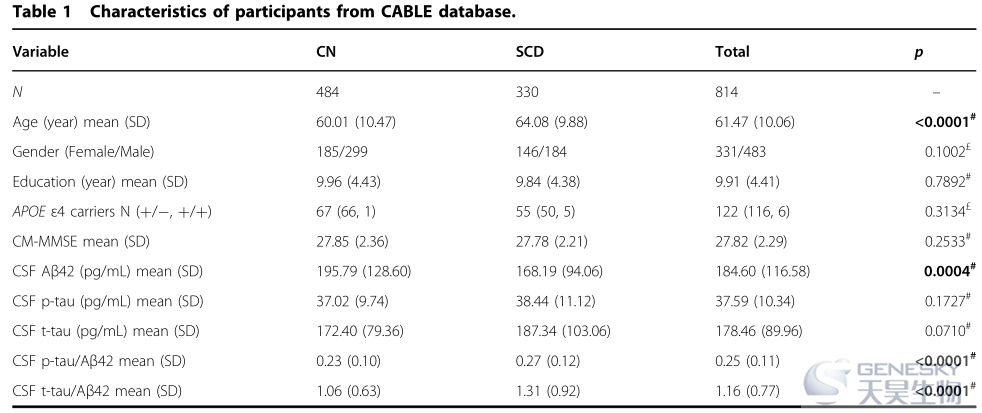
1)SCD组与CN组相比,BIN1启动子的甲基化水平明显较低(P =8.47×10 -6 )(图1A)
2)基于ATN诊断标准的亚组分析得出:A+亚组的BIN1启动子甲基化水平明显低于A-亚组(P=0.0060)(图1D)
3)SCD+样本的BIN1启动子甲基化水平远低于没有明显Aβ42病理变化的CN样本(CN-)(图4)具体分析BIN1的6个甲基化检测片段,发现上述CN和SCD组之间的甲基化水平差异只存在于 BIN1_01区域(p=1.63×10-5)(图1G),而在其他区域(BIN1_02-06)并不存在(图1H-L)。
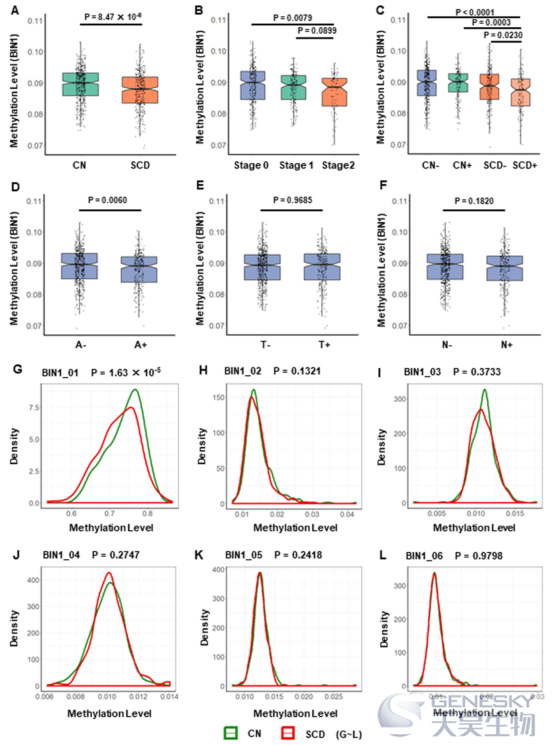
5)在调整了年龄、性别、教育和APOE?4状态这些协变量后,逻辑回归分析显示,BIN1启动子的低甲基化水平与SCD或SCD+有关(P<0.05)(图2)。
注:ATN诊断标准的生物标志物包括:Aβ(A);病理性Tau,包括总Tau和磷酸化Tau(T)和神经变性(N);A−T−N−定义为stage0,A+T−N−定义为stage1,A+T+N−,A+T−N+, A+T+N+定义为stage2。SCD样本中的A+患者定义为SCD+。CN样本中的A-患者定义为CN-。
● BIN1启动子的甲基化水平与CSF AD核心生物标志物之间的关联性
1)在总样本中,BIN1启动子的低甲基化与CSF Aβ42的减少有关(p=0.0008),也与p-tau/Aβ42(p=0.0001)和t-tau/Aβ42(p<0.0001)的增加有关。且上述关联只存在于BIN1_01区域,而不存在于其他五个区域。
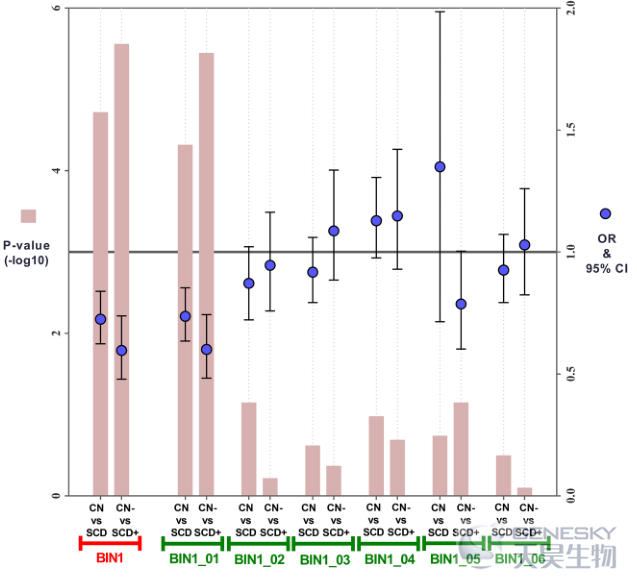
2)亚组分析显示,上述关联仅在SCD亚组中存在(图3K)。
3)在矫正了CSF Aβ42的影响后,发现在SCD亚组中,BIN1启动子的低甲基化仍然与tau-related biomarkers (CSFp-tau or t-tau)的水平相关。
图3K: BIN1_01区域附近一些CpG位点的甲基化水平与SCD亚组的CSF AD生物标志物有关,但与CN亚组无关。
1)将APOE?4 状态与BIN1的甲基化水平互做作为变量纳入多元线性回归分析,发现BIN1启动子的甲基化水平仍与CSFAβ42、p-tau/Aβ42和t-tau/Aβ42显著相关(表3)。
2)基于APOE?4 状态的分组分析显示,BIN1甲基化水平与CSF Aβ42、p-tau/Aβ42和t-tau/Aβ42的相关性在APOE?4携带者和非携带者组都有显著意义(图4)。
3)在矫正了BIN1启动子区2个高频SNP的影响后,BIN1启动子的甲基化水平仍与CSFAβ42、p-tau/Aβ42和t-tau/Aβ42显著相关。
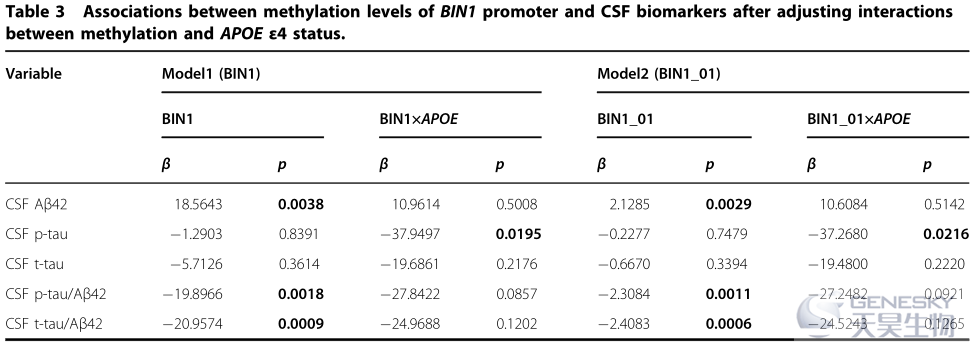
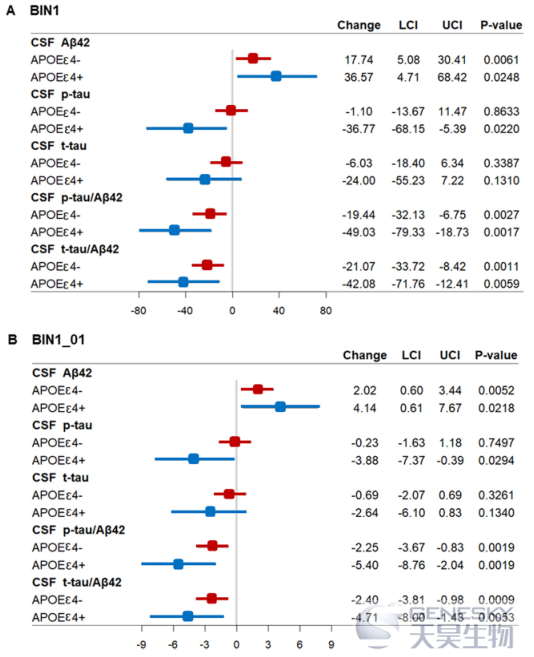
图4 不同APOE ε4状态下BIN1启动子甲基化水平与CSF AD生物标志物之间的关系
● 敏感性分析:在矫正了外周血细胞计数和样本储存的时间影响后,并未显著影响上述的相关性结果。
本研究首次提出了外周血中BIN1启动子的低甲基化与临床前AD的显著相关性。尽管其潜在的机制并不完全清楚,但这些强有力的结果仍然为BIN1启动子参与AD的发生和发展提供了新的证据。值得注意的是,本研究的结果表明,BIN1低甲基化对AD病理的这些影响可能发生在非常早期的阶段,这对于AD的早期干预和预防更为重要。此外,由于DNA甲基化比基因突变更具可塑性,未来在这个方向上的研究将更有可能找到可行和有效的治疗方法。
邮箱:techsupport@geneskies.com

创新基因科技,成就科学梦想

 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886








前往“发现”-“看一看”浏览“朋友在看”