中南大学湘雅医院骨科谢辉教授团队的研究成果近期发表在国际顶尖期刊《Advanced Science》上,研究成果发现来自儿童肠道微生物群的细胞外囊泡进入骨骼从而可以保持骨量和强度,在这项研究中天昊生物有幸承担了样品的相对定量扩增子测序和生信分析工作。在恭喜客户发表文章同时,我们想跟大家分享一下文章的研究思路。
英文题目:Extracellular Vesicles from Child Gut Microbiota Enter into Bone to Preserve Bone Mass and Strength
中文题目:来自儿童肠道微生物群的细胞外囊泡进入骨骼以保持骨量和强度
期刊名: Advanced Science
影响因子:15.840

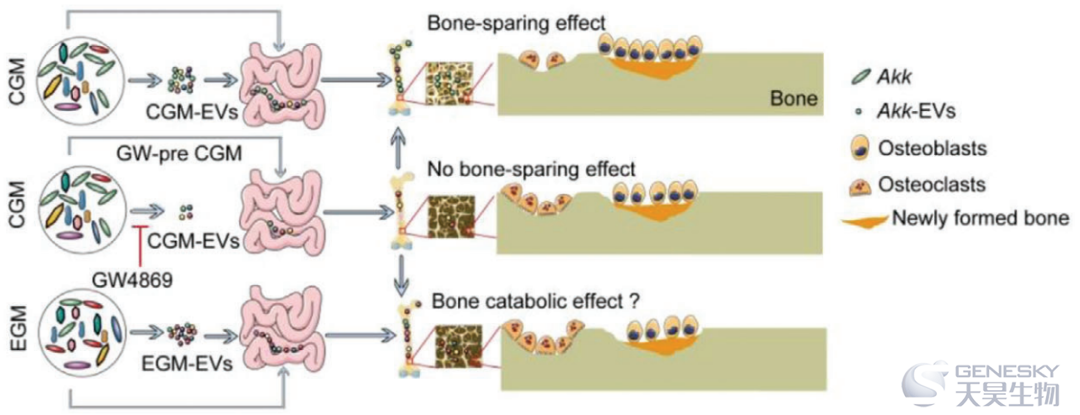
最近,肠道微生物群(GM)已被证明是骨内稳态的调节者,肠道微生物群调节骨量的机制仍在研究中。在这里,我们发现来自儿童(CGM)而不是来自老年人(EGM)的肠道微生物群的定植阻止了传统饲养的卵巢切除(OVX)诱导的骨质疏松小鼠模型(绝经后骨质疏松症动物模型)的骨量和骨强度的降低。16S rRNA扩增子测序显示儿童肠道微生物群(CGM)逆转了OVX诱导的Akkermansia muciniphila (Akk)的减少;直接补充Akk足以纠正OVX引起的骨代谢失衡,预防骨质疏松;机制研究表明,细胞外囊泡(EVs)的分泌是CGM和Akk诱导的骨保护作用所必需的,这些纳米小泡可以通过增强成骨活性和抑制破骨细胞的形成而进入并积聚到骨组织中,从而减弱OVX诱导的骨质疏松表型。本研究表明,肠道细菌Akk介导儿童肠道微生物群(CGM)诱导的抗骨质疏松作用,并提出了肠道微生物群与宿主骨之间信号交换的新机制。

骨质疏松症是老年人尤其是绝经后妇女常见的骨病。改善骨骼健康和预防骨质疏松症仍需要更理想的干预措施。肠道微生物群(GM)是宿主胃肠道内的微生物群落(细菌、真菌、病毒等)。宿主肠道为GM的生长提供了一个环境,GM中的一些成员,如一些肠道细菌,通过调节肠道发育、营养物质消化、免疫状态和大脑等各种生理过程,参与维持宿主体内平衡。最近的研究也将GM与骨骼健康联系起来。Sjögren等人发现,7周龄的无菌雌性C57BL/6小鼠的破骨细胞数量较少,骨量也高于年龄和性别匹配的常规饲养小鼠;无菌小鼠1个月的细菌定植使骨量正常化,这表明GM对骨骼有负面影响。然而,Quach等人最近的一项研究表明,在4周大的无菌雄性和雌性瑞士Webster小鼠和C57BL/6小鼠中,用小鼠或人类来源的GM定植不会导致骨丢失。Schwarzer等人发现,8周龄的无菌雄性BALB/c小鼠的骨生长速度比传统饲养的小鼠慢。Yan等人报道,2个月大的无菌雌性和雄性CB6F1小鼠长期定植3个月大的特异性无病原体(SPF)雄性小鼠的粪便微生物群,导致股骨长度显著增加,骨小梁微结构有改善的趋势,因此,GM对骨骼也有积极作用。关于GM对骨影响的不同结果可能是由于小鼠的品系、年龄、性别或定植时间的不同,另一个可能决定GM对骨影响的关键变量是微生物的群落组成,有证据表明,常规雌性C57BL/6小鼠在断奶或出生时接受抗生素治疗3或20周后,骨密度(BMD)增加。抗生素暴露不会降低肠道微生物丰度,但显著改变了肠道微生物群落组成,增加了肠道微生物群的系统发育多样性,提示某些肠道微生物丰度的变化可能与抗生素治疗对骨量的积极作用有关。以往的研究已经证实了许多益生菌对骨骼健康的有益作用,提示GM对骨骼的影响是具有微生物特定性的。GM可能由有益或有害于骨骼健康的微生物组成,群落结构的改变可能导致GM对骨骼的不同影响。
GM组成会受到各种因素的影响,如雌激素缺乏和衰老。骨骼老化和雌激素缺乏可导致骨重塑失衡,其特征是骨吸收大于骨形成,从而导致骨丢失甚至骨质疏松。考虑到不同的研究表明GM对骨健康有不同的影响,这种差异可能与GM组成的改变有关,我们推测某些微生物丰度的变化可能是导致骨重建失衡和随后骨丢失的关键因素,因此,识别调节这一过程的微生物以及如何恢复平衡的GM以预防骨质疏松变得尤为重要。据报道,用瘦人粪便微生物群移植可减少肥胖受体小鼠的肥胖症增加;用马拉维饮食的小鼠在接受营养不良的马拉维婴儿/儿童粪便微生物群后变得营养不良,提示GM具有将某些表型从供体转移到受体的潜力。由于儿童时期是一个快速生长的时期,我们推测健康儿童的GM可能含有有益于骨健康的特定微生物,与儿童GM或有益微生物一起移植可能能够恢复骨质疏松患者的骨重建平衡并诱导健康的骨表型。
鉴于GM在调节骨健康方面的重要性,探讨GM与宿主骨的通讯机制具有重要意义。近年来,在原核生物和高等真核生物中,细胞间的生物信号交换主要是通过胞外囊泡的分泌来实现的。在革兰氏阴性菌和某些革兰氏阳性菌中普遍存在EVs产生。GM衍生的EV(20-400 nm)使细菌能够以集中和保护的方式将多种效应分子传递到远处的靶细胞,从而调节受体细胞的功能。2013年,Kang等人对粪便来源的EV进行了鉴定,发现粪便细菌Akkermansia muciniphila(Akk)的EV可以抑制大肠杆菌来源的EV诱导的结肠上皮细胞炎症,并保护小鼠免受实验性结肠炎的影响,这表明来自GM特定成员的EV具有功能作用。最近,Choi等人报道,口服高脂饮食喂养的小鼠粪便来源的EV或肠道共生的Pseudomonas panacis来源的EV可诱导受体老鼠产生胰岛素抵抗和葡萄糖不耐受。此外,他们还发现,Pseudomonas panacis来源的EV可穿过小鼠肠上皮屏障,进入肝脏、脂肪组织和骨骼肌等胰岛素敏感组织,这意味着GM可以通过EV与靶细胞的直接相互作用来调节宿主远端器官的功能,这提示我们探讨功能性EVs从特定微生物向骨组织的转移是否是GM诱导的骨健康调控的关键机制。
在这里,我们探讨了常规饲养的卵巢切除(OVX)诱导的骨质疏松C57BL/6小鼠接受来自健康儿童的GM的定植是否可以通过逆转有益于骨健康的特定肠道微生物水平来诱导骨生长和预防骨质疏松,我们还确定了功能性EVs从这些特定微生物向骨细胞的远端转移是否是GM调节骨量的关键机制。
健康儿童GM(CGM)预防OVX小鼠骨丢失并改变骨代谢
为了探讨GM是否能预防骨质疏松症患者的骨丢失,我们在常规饲养的C57BL/6小鼠上通过OVX手术建立了绝经后骨质疏松症动物模型。我们分别从三个不同家庭(每个家庭一个CGM供体和一个EGM供体)的三名健康儿童和三名健康老人身上采集儿童肠道菌群(CGM)和老年人肠道菌群(EGM)样本。表S1显示了显示供体受试者代谢状态的参数水平,包括体重、身高、体重指数(BMI)、血糖、血清总蛋白、白蛋白、球蛋白、白蛋白/球蛋白比率、总胆固醇和甘油三酯。CGM和EGM供体的这些参数主要在正常水平范围内波动(表S1),表明所有CGM和EGM供体都处于健康的代谢状态。与CGM供体相比,EGM供体的血糖、血清总蛋白、球蛋白、总胆固醇和甘油三酯的平均值较高,血清白蛋白和白蛋白/球蛋白比值较低,但仅呈趋势(表S1)。我们将不同供者来源的CGM或EGM混合均匀,观察其对骨代谢的影响。
图S1A显示,与假手术(Sham)小鼠相比,所有OVX小鼠的体重均增加,与先前研究的结果一致。与假手术小鼠相比,所有OVX小鼠的子宫重量和子宫大小均减少,证实了OVX的成功(图S1B,C)。股骨显微计算机断层扫描(µCT)分析显示,与假手术小鼠相比,溶媒(vehicle)处理的OVX小鼠表现出明显的骨量减少和骨微结构受损,表现为BMD,小梁骨体积分数(Tb. BV/TV),小梁数(Tb.N),小梁厚度(Tb.Th),皮质骨面积分数(Ct. Ar/Tt. Ar)和皮质厚度(Ct.Th)降低,皮质骨面积(Ct.Ar)具有减少趋势;而溶媒处理的OVX小鼠的小梁间距(Tb.Sp)明显高于假手术小鼠小鼠(图1A-G;图S1D-F)。
经过8周每周两次口服合并CGM(而非EGM)后,大多数显示骨量或骨微结构改变的参数显著逆转(图1A-G;图S1D-F)。与骨量和骨微结构恢复一致,股骨长度分析和三点弯曲试验表明,合并CGM的定植导致OVX小鼠股骨长度进一步增加,并阻断股骨最大弯曲负荷的降低,然而,EGM移植导致骨长度和强度下降(图1H,I)。为了排除个体差异的可能性,我们随后从上述供体获得新鲜的CGM和EGM样品,并且不混合来自不同供体的CGM或EGM样品。与假手术小鼠相比,在所有OVX小鼠中观察到体重显著增加(图S2A)和子宫重量减少(图S2B),进行了动物实验来评估来自这些供体的CGM和EGM对骨健康的影响,结果显示,所有儿童供体来源的GM,与来自不同儿童供体的混合GM相似,能够独立抑制OVX小鼠的骨量损失,但上述供体的EGM均未诱导显著的骨保护作用(图1J-P;图S2C-E)。此外,与溶媒(vehicle)处理的OVX小鼠相比,用供体2-和供体3-衍生的CGM(CGM2和CGM3)处理的OVX小鼠显示出明显增加的股骨长度,但是在用不同供体的每种EGM处理的OVX小鼠中未检测到这种效应(图1Q)。所有CGM(非任何一种EGM)也显著逆转了OVX引起的股骨最大弯曲负荷的减少(图1R)。这些结果表明,年轻供体移植GM可以抑制OVX小鼠的骨丢失,促进骨生长,维持骨强度,并且GM的抗骨质疏松作用随着供体年龄的增长而丧失。
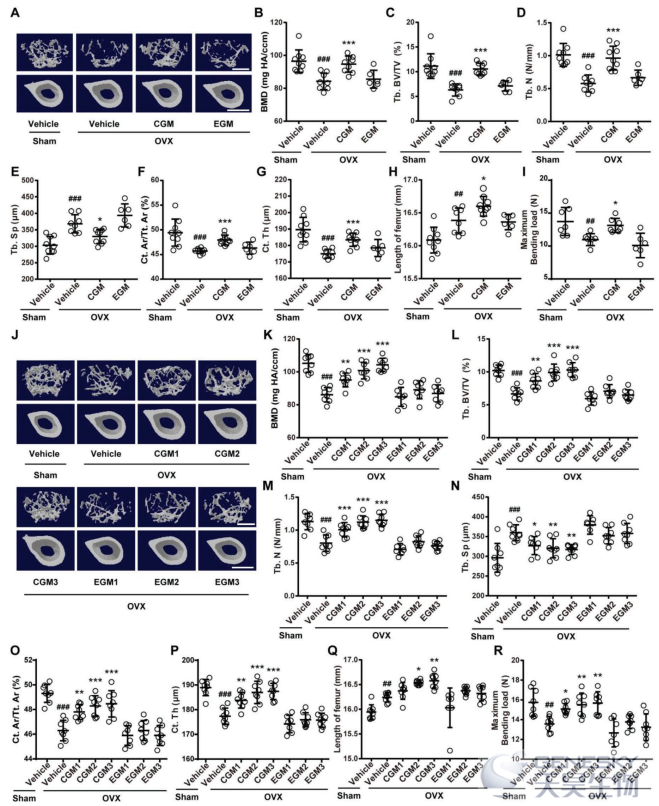
然后我们测试了不同来源的CGM和EGM对OVX小鼠成骨和破骨细胞生成的影响。OCN免疫组化染色显示,与假手术小鼠相比,溶媒处理的OVX小鼠的小梁骨表面上有更多的成骨细胞,并且上述每种儿童供体来源的GM的定植到OVX小鼠进一步增加了成骨细胞的数量(图2A,B),然而,在用任何一种获得的EGM治疗的OVX小鼠中均未观察到促成骨作用(图2A,B)。同样地,酶联免疫吸附试验(ELISA)显示,不同供体来源的CGM(而非EGM)的定植进一步增加了OVX小鼠的血清骨钙素水平(OCN,成骨分化的标志物)(图2C)。抗酒石酸酸性磷酸酶(TRAP)染色表明,OVX诱导破骨细胞的数量和大小显著增加,但通过不同供体来源的CGM的定植作用,这种作用完全逆转(图2D,E),在所有EGM定植的OVX小鼠中未观察到破骨细胞数量和大小的显著变化(图2D,E;图S2F)。ELISA显示,所有供体来源的CGM显著抑制OVX诱导的I型胶原C末端末端肽(CTX-I)血清水平的增加,而EGM处理的OVX小鼠与溶媒处理的OVX小鼠相比,该骨吸收标记物的血清水平表现出进一步增加的趋势(图2F),这表明EGM对骨分解代谢的影响。钙黄绿素双标显示,不同来源的CGM移植可以挽救OVX小鼠新骨形成和矿化的损伤,而所有来源的EGM均不影响这一过程,如每个骨表面的骨形成率(BFR/BS)和矿物沉积率(MAR)值所示(图2G-I)。这些结果表明,CGM在骨质疏松小鼠体内的定植通过促进成骨细胞骨形成和抑制破骨细胞骨吸收来逆转骨代谢失衡,最终增加骨量和强度。

为了找出介导CGM的对骨有益作用的有益微生物,我们从Sham + Vehicle,OVX + Vehicle,OVX +合并CGM和OVX +合并EGM组的小鼠中收集了粪便标本,并通过16S rRNA扩增子测序来评估这些标本中的微生物组成。从三个不同的CGM和EGM供体获得CGM和EGM样品,并使用16S rRNA扩增子测序对微生物群丰度进行相对定量。在门、纲、目、科、属和种的水平上对鉴定的微生物群的组成进行了分析(图3A、B;表S2和S3),在门水平上,与假手术对照组相比,OVX诱导了Verrucomicrobia 和Deferribacteres显著减少,Candidatus Saccharibacteria 和Tenericutes显著增加(图3A;表S2)。无论使用CGM还是EGM,定植后的OVX小鼠都会导致放线菌和厚壁菌的增加(图3A;表S2,支持信息),这可能是由于小鼠和人类之间肠道微生物群落结构的差异,CGM和EGM样本的16S rRNA基因测序数据证实了这一假设,与小鼠粪便微生物群相比,CGM和EGM样本中放线菌门和厚壁菌门的细菌丰度更高(表S3)。令人惊讶的是,最重要的是,OVX诱导的Verrucomicrobia的缺失完全通过CGM的定植而得以挽救,而不是EGM(图3A;表S2),这意味着恢复Verrucomicrobia的细菌水平可能有助于CGM诱导的骨获益。在属水平上,发现Verrucomicrobia中新鉴定的属Akkermansia被OVX抑制,并被CGM处理逆转,而在上述小鼠的粪便样本中未检测到该门中的其他属(图3B;表S2)。在种水平上,在Akkermansia属中仅检测到Akk,并且在OVX后表现出显著的减少,并且在使用CGM移植的OVX小鼠中表现出显著的恢复(图3B;表S2)。以Akk基因16S rRNA可变区为靶点的定量实时PCR(qRT-PCR)分析表明,不同供体来源的CGM,类似于这些供体的合并CGM,能显著逆转OVX诱导的肠道细菌Akk的减少,而来自不同供体的每一种EGM在OVX小鼠中都不能恢复Akk丰度(图3C)。供体CGM和EGM样本的16S rRNA扩增子基因测序显示CGM供体的Akk水平高于EGM供体(表S3),一致地,qRT PCR证实EGM供体粪便微生物群中的Akk水平远低于CGM供体(图3D)。与CGM2和CGM3相比,CGM1表现出诱导骨获益能力较低的趋势,在不同供体来源的CGM中,Akk水平最低(图3D),这些结果提示Akk的丢失可能与OVX引起的骨质疏松有关,补充Akk可能是CGM预防骨质疏松的重要机制。

图3 CGM可挽救骨质疏松症小鼠肠道Akk的丢失,补充Akk可减轻OVX小鼠的骨质疏松表型
接下来,我们确定每周两次连续8周直接补充Akk是否足以预防OVX诱导的小鼠骨质疏松症,并用大肠杆菌(一种细菌,通常存在于人类和温血动物的肠道中,在本研究中,也存在于所有溶媒处理的假手术小鼠的粪便微生物群中)比较Akk对骨骼的影响。µCT分析显示,口服活性Akk可阻断OVX诱导的骨量丢失,并改善骨微结构,如与溶媒处理的OVX小鼠进行比较,其BMD、Tb. BV/TV、Tb. N、Ct. Ar/Tt. Ar、Ct. Th增加,同时Tb. Sp减少(图3E-K)。用活性Akk治疗也能显著逆转OVX诱导的Ct. Ar降低,但是对Tb. Th和Tt. Ar无显著影响(图S3A-C,支持信息)。然而,大肠杆菌对OVX小鼠的骨量和骨微结构没有明显的影响(图3E-K;图S3A-C),对应地,骨长分析和三点弯曲试验分别表明,Akk(而不是大肠杆菌)能够增加OVX小鼠的骨长和恢复骨强度(图3L,M)。
接下来,我们检测Akk是否能像CGM一样增加成骨和减少破骨细胞的生成。OCN免疫组化染色和这种骨形成标记物的ELISA试验表明,与溶媒处理的VX小鼠相比,用Akk移植的OVX小鼠的成骨反应显著增加(图3N- P),然而,大肠杆菌诱导成骨细胞数量减少的趋势,并且不影响OVX小鼠的血清OCN水平(图3N-P)。CTX-I的TRAP染色和ELISA显示,施用Akk(而非大肠杆菌)可抑制OVX诱导的破骨细胞形成、破骨细胞大小和骨吸收活性的促进(图3Q-S;图S3D)。钙黄绿素双重标记显示,与溶媒处理的OVX小鼠相比,经Akk处理的OVX小鼠中新骨形成和矿化增加,而大肠杆菌导致BFR/BS和MAR值下降的趋势(图3T-V)。上述结果提示,肠道细菌Akk通过促进成骨和减少破骨细胞的生成而介导的骨有益作用可能是CGM对骨有益的重要因素。
为了研究EVs在CGM诱导的抗骨质疏松作用中的作用,我们用GW4869(一种能够抑制EVs释放的中性鞘氨醇髓鞘酶(nSMase)抑制剂)对供体1的CGM进行预培养,以干扰CGM对EVs的分泌。然后,我们评估了这些GW4869预处理的CGM每周两次连续8周的胃内给药是否可以预防OVX诱导的小鼠骨质疏松症。实验程序的示意图如图4A所示,在YCFA琼脂平板上进行细菌菌落计数试验,以评估GW4869对CGM活力的影响。如图4B所示,在YCFA琼脂平板上4天后,GW4869和溶媒处理的CGM之间的细菌菌落数没有统计学上的显著差异,表明细菌的活力没有受到GW4869的损害。EV蛋白是EV数量的一个指标,EV水平与总EV蛋白浓度的归一化是一种简单而广泛应用的EV定量方法。如图4C所示,用GW4869处理4天后,在CGM中EV的产生被显著抑制,如分离的EV的总蛋白质含量显著降低,即使将GW4869从培养基中去除,并将处理过的CGM再培养4天,GW4869预处理过的CGM中EV的蛋白质含量仍远低于溶媒预处理组(图4C)。我们还使用纳米颗粒跟踪分析(NTA)来确定GW4869或溶媒处理的CGM中EV的颗粒数,与EVs蛋白质含量的变化一致,GW4869处理4天后,CGM中EVs的颗粒数显著减少,当GW4869从培养物中去除4天后,仍然观察到减少(图4D)。这些结果表明GW4869对EV有持久的抑制作用。引人注目的是,µCT分析显示,GW4869预处理几乎完全消除了CGM改善OVX小鼠骨量和骨微结构的能力,GW4869预处理的CGM和溶媒处理的OVX小鼠之间这些骨量和微结构参数的可比水平表明了这一点(图4E-K;图S4A-C),表明EVs的分泌是CGM骨保护作用所必需的。
然后,我们通过使用GW4869确定EV的产生是否对Akk的骨骼有益作用是必要的。细菌菌落计数分析表明,用GW4869处理不会影响Akk的活性(图4L)。GW4869对Akk产生EV的抑制作用是通过当其亲本细菌Akk用GW4869处理或预处理时,Akk产生的EV(Akk EVs)的总蛋白质含量和颗粒数显著减少来证实的(图4M,N),这与在用GW4869预孵育的CGM处理的OVX小鼠中观察到的结果一致。µCT分析显示,用GW4869预处理Akk也可消除Akk防止OVX诱导的骨量损失和骨微结构损伤的能力(图4O-U;图S4D-F)。股骨长度分析显示,GW4869预处理也阻断了Akk对骨纵向生长的促进作用(图4V)。这些结果表明EVs是Akk诱导的抗骨质疏松活性的主要效应因子。
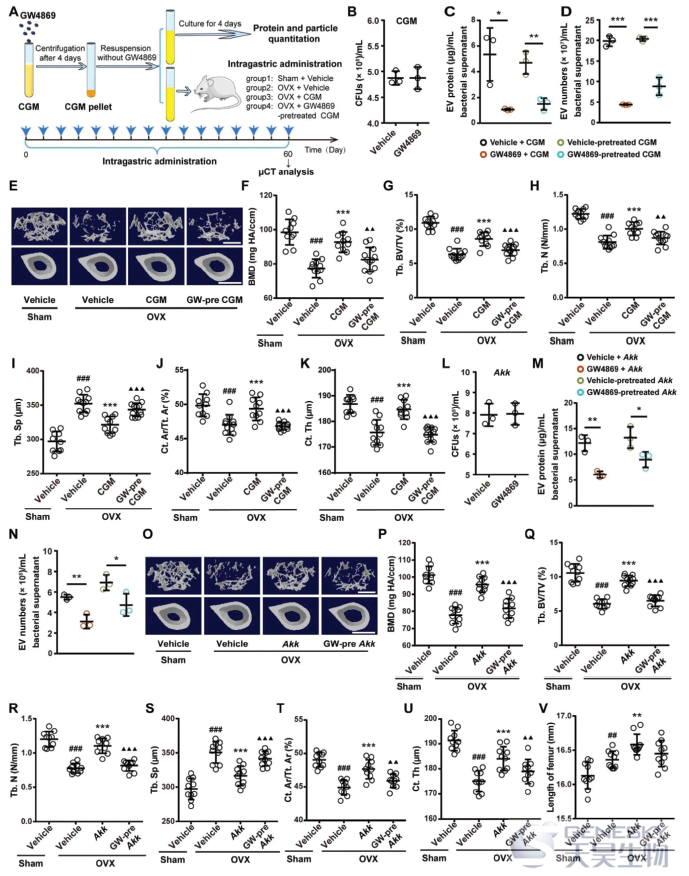
图4 EVs分泌是CGM和Akk抗骨质疏松活性所必需的
接下来,我们从CGM(CGM1、CGM2或CGM3)、EGM(EGM1、EGM2或EGM3)或Akk的培养基中分离EVs,并使用透射电子显微镜和动态光散射(DLS)分析对分离的EVs进行表征。如图5A、B所示,CGM1衍生EVs(CGM1-EVs)、EGM1衍生EVs(EGM1-EVs)和Akk-EVs呈杯状或球形,直径分别为207.25±54.23nm、193.99±57.66nm和172.81±27.80nm,与先前报道的细菌EVs相似。然后,我们用DIR-io-dide标记了三种不同的供体来源的CGM-ev(CGM1- EVs、CGM2- EVs和CGM3- EVs)、三种不同的供体来源的EGM-ev(EGM1- EVs、EGM2- EVs和EGM3- EVs)和Akk-ev,然后检测这些ev是否能被运输到宿主组织。体外荧光成像显示,经口、经直肠或静脉给药1h后,在小鼠胫骨和股骨中检测到高荧光信号,表明大量这些细菌EV进入宿主骨组织,在肝、肾、脑、肌肉和胃肠中也检测到荧光信号,其中肝、肌肉和胃肠显示出最高的荧光强度(图S6A,B)。这些EV也用绿色荧光染料(PKH67)标记,采用共聚焦显微镜检测经标记EV口服1小时的小鼠不同组织中的荧光信号,图S6C,D显示所有CGM EVs、所有EGM EVs和Akk EVs均成功转运至小鼠肝脏,肾脏和大脑。图5E显示PKH67标记的CGM1 EVs、EGM1 EVs和Akk EVs在小鼠骨组织中的存在,包括小鼠的骨膜、内膜、皮质骨、小梁骨和骨髓部位,提示这些EVs可能具有直接靶向骨细胞调节骨功能的能力代谢。定量平均荧光强度证实,所有CGM-EV、所有EGM-EV和Akk-EV都表现出类似的能力,可以运输到小鼠骨组织(图5F)。
我们还获得了Akk-EV免疫兔的血清,并用含有Akk-EVs抗体的血清来评估口服Akk-EVs是否能在小鼠组织中检测到。如图5G、H和图S6E、F所示,溶媒和Akk-EV处理的小鼠在骨、脑、肝和肾中均显示荧光信号,并且这些组织中的信号在Akk-EV处理的小鼠中比溶媒处理的对照小鼠高得多,提示Akk-EVs在生理条件下可以转运到宿主组织中,口服外源性Akk-EVs可进一步增加其在宿主组织中的丰度。

图5 CGM-EVs和Akk-EVs在体外可直接转运到小鼠骨组织中,促进成骨和抑制破骨细胞的生成
CGM-EVs和Akk-EVs在体外促进成骨和抑制破骨细胞的生成
我们接下来探讨了三种不同的供体来源的CGM EV(CGM1 EV、CGM2 EV和CGM3 EV)、三种不同的供体来源的EGM EV(EGM1 EV、EGM2 EV和EGM3 EV)以及Akk EV是否能够在体外和体外直接与骨细胞相互作用并比较CGM-EVs和Akk-EVs与EGM-EVs、EGM-EVs+Akk-EVs、不含EV组分和大肠杆菌衍生EVs(E.coli-EVs)调节成骨和破骨细胞生成的能力。以往的研究表明,10μg mL−1的细菌EV足以在体外诱导受体细胞产生显著的作用,我们发现不同批次的100μg CGM EV和Akk EV中的颗粒数分别主要在(3–7)×10 9囊泡((5.27±1.91)×10 9囊泡)和(5–7)×10 9囊泡((6.00±1.13)×10 9囊泡)的范围内(图S7A),因此选择6×10 8囊泡mL−1(≈10µgmL−1蛋白质含量)的剂量用于所有体外EVs相关分析,而不含EV组分的使用浓度为10µg mL−1蛋白质含量。
荧光显微镜显示,PKH26标记的3个CGM EVs、3个EGM EVs和Akk EVs在孵育3小时后可进入小鼠原代骨髓间充质干细胞(BMSCs)和破骨细胞祖细胞RAW264.7细胞的核周区(图S7B,C)。茜素红S(ARS)染色显示,在成骨诱导后,与溶媒处理的BMSCs相比,用CGM1 EVs、CGM2 EVs、CGM3 EVs或Akk EVs处理的BMSCs显示出更高水平的钙结节形成,但是用三种EGM EVs中的任何一种处理的BMSCs相比载体处理的BMSCs具有更少的矿化结节形成(图5I,J)。这三种CGM- EVs和Akk- EVs的显著促成骨作用通过成骨诱导下BMSCs中与成骨相关的基因(Bglap、Alpl和Runx2)的表达的qRT-PCR分析得到进一步证实(图S7D-F)。TRAP染色显示,这三种CGM-EVs和Akk-EVs显著减少了RAW264.7细胞形成的破骨细胞的数量和大小,但所有EGM- EVs导致破骨细胞数量和大小进一步增加(图5K,L;图S7G)。一致地,对破骨细胞生成相关基因(Trap、Ctsk、Mmp9、Ocstamp和Oscar)表达的qRT PCR分析也确定了所有CGM EV和Akk EV的抗破骨细胞生成作用,以及所有EGM EV的促破骨细胞生成作用(图S7H-1)。EGM-EVs联合Akk-EVs也促进了BMSCs矿化结节的形成,减少了RAW264.7细胞形成的破骨细胞的数量和大小,尽管其作用远低于Akk-EVs(图5I-L;图S7G),提示EGM-EVs+Akk-EVs或EGM+Akk可能具有诱导小鼠骨保护作用。来自不同供体来源的CGM、不同供体来源的EGM或Akk的培养上清的不含EV的部分对BMSCs的钙结节形成以及RAW264.7细胞形成的破骨细胞的数量和大小没有显著影响(图5I-L;图S7G),这些结果表明,分泌的EVs,而不是其他分泌因子,主要参与CGM和Akk的促成骨和抗破骨作用。
CGM-EVs和Akk-EVs对OVX诱导的骨质疏松有保护作用
然后,我们研究了不同供体的CGM EVs(CGM1 EVs、CGM2 EVs和CGM3 EVs)和Akk EVs以1.2×10 10囊泡(≈200 µg蛋白质含量)的剂量直接干预2个月是否足以保护OVX小鼠免于骨质疏松,并与来自不同供体的EGM-EVs(EGM1-EVs、EGM2-EVs和EGM3-EVs)和大肠杆菌EVs进行比较。µCT、股骨长度分析和三点弯曲试验分别表明,口服不同供体的CGM EVs或Akk EV可显提高OVX小鼠的松质骨和皮质骨量,改善骨微结构,增加股骨长度,并提高骨的力学骨强度(图6A-I;图S8A-C),然而,与溶媒处理的OVX小鼠相比,用EGM EVs或大肠杆菌EVs处理的OVX小鼠仍具有相似的BMD水平、骨微结构参数、骨长度和骨强度(图6A-I;图S8A-C)。口服CGM-EVs和Akk-EVs还可以增加OVX小鼠的成骨细胞数量和成骨活性,分别通过OCN免疫染色(图6J,K)和血清OCN的ELISA(图6L)得到证实。TRAP染色(图6M,N;图S8D)和CTX-I的ELISA试验(图6O)显示CGM-EVs和Akk-EVs抑制OVX诱导的破骨细胞数量和大小的增加以及骨吸收活性。钙黄绿素双重标记显示,口服CGM EVs或Akk EVs后,OVX小鼠的新骨形成和矿化显著增加(图6P-R)。如µCT扫描数据和股骨长度值的变化所示,静脉注射来自不同供体的CGM EVs或Akk EVs的OVX小鼠也观察到了对骨量、骨微结构和骨长度的有益影响,但EGM EVs治疗组没有观察到这种有益影响(图S9A-K)。总之,这些结果表明CGM-EVs和Akk-EVs与CGM和Akk一样,能够通过促进骨形成和抑制骨吸收来保持骨量和骨强度。随着GM供体的老化,GM来源EVs的骨保护作用逐渐丧失,这些发现进一步提示了EVs在GM功能中的介导作用。
综上所述,我们的研究结果表明,来自CGM的EVs,特别是来自CGM中Akk的EVs,通过促进成骨细胞骨形成和抑制破骨细胞骨吸收发挥保骨作用(图6S)。EGM缺乏Akk,给予EGM或其EVs不能诱导骨保护作用;尽管当前剂量的EGM或EGM EVs没有对发生骨质疏松的骨产生不良影响,但EGM EVs在体外可以减少成骨和增加破骨细胞的形成,表明EGM可能有促进骨的分解代谢作用(图6S)。
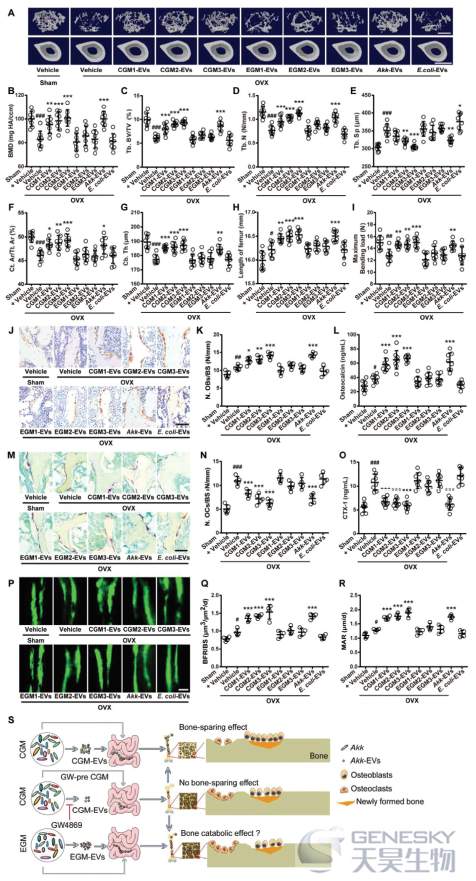
图6 口服后,CGM-EVs和Akk-EVs可以抵抗OVX引起的骨质疏松症
天昊微生物项目文章:pH引起的真菌丰度和组成的变化会影响人工控制pH值30天后的土壤异养硝化作用;
天昊微生物项目文章:红曲菌发酵的荞麦通过调节肝脏代谢物和肠道微生物来预防血脂异常和非酒精性脂肪肝;
天昊微生物项目文章:吗啡诱导的条件性位置偏爱不同阶段肠道菌群的变化;
喜讯!天昊生物微生物项目文章登陆《Environmental Pollution》;
喜讯!天昊微生物项目文章登陆国际精神疾病领域顶级期刊《Molecular Psychiatry》;
喜讯!天昊微生物测序项目文章登陆Cell子刊《Current Biology》;
【昊文章】天昊肠道微生物测序项目文章三连击!;
天昊生物微生物项目新文:沸石-纳米零价铁复合材料对农田土壤中镉、铅、砷的固定化:封存机制与微生物响应;
新年开篇!天昊生物微生物项目文章登陆《Biology and Fertility of Soils》;
辞旧迎新,天昊生物微生物项目文章盘点;
喜讯!天昊生物微生物项目文章登陆《Environmental Pollution》;
天昊微生物项目文章:【SBB】了解长期施加有机物料如何增加土壤磷酸酶活性:针对phoD和phoC功能性微生物种群的研究;
咨询沟通请联系
18964693703(微信同号)

创新基因科技,成就科学梦想

 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886